Organisering av nylig kopiert DNA i Escherichia coli
Figur 1
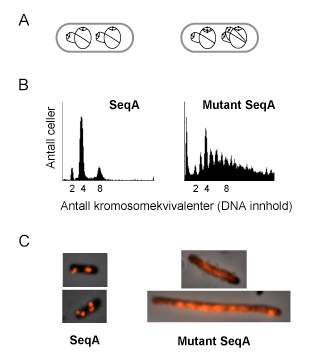
Figur 1. Dannelse av et SeqA-proteinfilament kreves for å hindreekstra kopieringer av kromosomet (B) og for å organisere nylig kopiert DNA (C).
A: Skjematisk fremstilling av hurtigvoksende celler med overlappende kopieringssykluser. Kromosomet er tegnet som en svart sirkel og origo er tegnet som en svart prikk. Normale celler starter kopieringen fra alle origoene på samme tidspunkt i cellesyklus (venstre). I celler som mangler kontroll med kopiering av kromosomene vil kopieringen kunne starte en ekstra gang fra ett eller flere origoer i samme cellesyklus (høyre).
B: Flow cytometri analyse av celler som er farget med et DNA-spesifikt stoff. Mengde fluorescence som måles er proporsjonalt med mengde DNA i cellen. Hurtigvoksende celler som inneholder SeqA-protein har normal kontroll av kopiering av kromosomene og vil inneholde 2n (n=0,1,2...) kromosomer. Mutant SeqA-protein klarer ikke å hindre ekstra kopieringer av kromosomet i samme cellesyklus. Dette vises i DNA-histogrammet hvor celler med mutant SeqA-protein kan inneholde alle mulige antall kromosomer. Tilsvarende situasjon gjelder for celler som mangler SeqA-protein. Mangelen på kontroll av kopiering skyldes at mutant SeqA-protein har mistet evnen til å danne et proteinfilament.
C: Intracellulær lokalisering av henholdsvis SeqA-protein og mutant SeqA-protein. Cellene er merket med primært antistoff mot SeqA-protein, deretter sekundært antistoff koblet til et rødt fluorescerende molekyl, Cy3, og visualisert i et fluorescence mikroskop. Celler som inneholder SeqA-protein danner avgrensede proteinkomplekser, som representerer SeqA-protein bundet til nylig kopiert DNA på replikasjonsgaflene. Mutant SeqA-protein klarer ikke å danne avgrensede komplekser i cellen siden proteinet ikke klarer å danne et proteinfilament.
Doktoravhandling
Tittel
The role of the Escherichia coli SeqA protein in organization of newly synthesized DNA
ISBN 978-82-8072-287-4
Emne
Cellebiologi
Stipendiat
Ingvild Odsbu, Avdeling for cellebiologi, Institutt for kreftforskning, Det Norske Radiumhospital, Oslo universitetssykehus HF
ingvild.odsbu@rr-research.no
Veiledere
Professor Kirsten Skarstad, Avdeling for cellebiologi, Institutt for kreftforskning, Det Norske Radiumhospital, Oslo universitetssykehus HF
Forsvar av oppgaven
2009, høst
Hovedbudskap
Spesifikke N-terminale vekselvirkninger mellom SeqA-proteiner kreves for at det skal dannes en høyere ordens proteinstruktur som organiserer nylig kopiert DNA.
Eksisterende SeqA-strukturer trekker til seg nylaget DNA mens kopieringen foregår og kan ha en rolle i fordelingen av de kopierte kromosomene til hver dattercelle før celledeling.
Ingvild Odsbu
Avdeling for cellebiologi, Institutt for kreftforskning, Det Norske Radiumhospital, Oslo universitetssykehus HF
E-post: ingvild.odsbu@rr-research.no
BAKGRUNN
For at arvematerialet (DNA) skal kunne overføres intakt fra én generasjon til den neste må en identisk kopi av DNA-molekylet lages før hver celledeling. I cellen er DNA-molekylet fordelt på flere biter hvor hver enkelt bit er kveilet sammen med protein i en struktur som kalles et kromosom. Det er viktig at kopieringen av kromosomene skjer til rett tid og kun én gang per celledeling. Feilregulering av denne prosessen kan resultere i at kromosomene kopieres ufullstendig eller at det blir for mange kopier i cellen. Dette kan igjen gi opphav til brudd på kromosomene (fragmentering) og mulighet for kromosomrearrangeringer som vil kunne omdanne en normal celle til en kreftcelle. Studier av regulering av kopiering av DNA er derfor viktige for å øke vår forståelse for utviklingen av kreftceller.
Kopiering av DNA (DNA-replikasjon) krever at de to trådene i DNA-dobbelheliksen separeres. Trådene separeres først i en spesifikk region på kromosomet for deretter å tvinnes opp videre i begge retninger. Samtidig som dobbelheliksen tvinnes opp syntetiseres nytt DNA hvor hver tråd i dobbelheliksen brukes som oppskrift (templat) for syntese av en identisk kopi (semikonservativ replikasjon). Etter at kopieringen er ferdig vil cellen inneholde to datterkromosomer som hver består av en gammel og en ny DNA-tråd. De to datterkromosomene fordeles til hver dattercelle ved celledeling.
Bakterien Escherichia coli (E. coli) er en encellet organisme som inneholder ett sirkulært DNA-molekyl (kromosom) og som dermed egner seg godt til studier av regulering av kopiering av kromosomet. Funn gjort i denne organismen kan nyttiggjøres i studier av de samme prosessene i andre celletyper da biokjemiske prosesser er bevart gjennom evolusjonen. Både positive og negative faktorer regulerer kopieringen av kromosomet. SeqA-proteinet i E. coli er en slik negativ faktor. Når kopieringen av DNA starter fra en spesifikk region på kromosomet kalt origo, vil to nye origoer lages, én for hvert datterkromosom. SeqA-proteinet binder spesifikt til de nye origoene og hindrer dermed at trådene i dobbelheliksen separeres en ekstra gang i samme cellesyklus. Dermed vil ikke en ny runde med kopiering kunne starte. Dersom cellen mangler dette proteinet, skjer kopieringen av kromosomet uten kontroll og cellen ender opp med for mange kopier av kromosomet. I tillegg til å binde til de nye origoene binder også SeqA-proteinet til det området på kromosomet der trådene separeres og nytt DNA syntetiseres, det vil si til nylig kopiert DNA. Dette området betegnes som replikasjonsgaffelen. En E. coli-celle inneholder ett sirkulært kromosom, og siden DNA tvinnes opp i begge retninger fra origo vil det være to replikasjonsgafler på kromosomet der DNA kopieres. Under gode vekstbetingelser vil E. coli-cellen ha en doblingstid som er mye kortere enn tiden det tar å kopiere hele kromosomet. Dette problemet løses ved at kopieringen av DNA starter i den forrige eller en enda tidligere generasjon. Dermed vil cellen inneholde et kromosom med flere replikasjonsgafler (opptil 24 replikasjonsgafler er mulig) som følge av overlappende kopieringssykluser (figur 1A). SeqA-proteiner bundet til replikasjonsgaffelen danner store komplekser i cellen som kan visualiseres ved hjelp av fluorescens mikroskopi (figur 1C). En tidligere studie har vist at hvert slikt SeqA-kompleks inneholder flere replikasjonsgafler (1).
HENSIKT
Formålet med denne avhandlingen var å undersøke hvordan SeqA-proteiner binder til hverandre og danner en høyere ordens- struktur som består av mange SeqA-proteiner. Videre ønsket vi å undersøke hvordan denne strukturen organiserer nylig kopiert DNA. Det har blitt foreslått at enzymer involvert i syntesen av DNA-byggesteiner og enzymer involvert i kopieringen av kromosomet sitter sammen i et stort kompleks for å gjøre kopieringen mer effektiv. SeqA-proteinet kan være involvert i å holde dette komplekset sammen. Vi ønsket å undersøke om organiseringen av nylig kopiert DNA endres når det er for få DNA-byggesteiner i cellen.
MATERIALER OG METODER
En rekke molekylærbiologiske og biokjemiske metoder som affinitetskromatografi, gelfiltrering, DNA-protein interaksjonsstudier (gel retardasjon og DNA-topologi eksperimenter) ble benyttet for å rense og karakterisere en mutant utgave av SeqA-proteinet. Videre ble det benyttet flow cytometri, Southern blotting og kvantitativ PCR for detaljerte studier av cellesyklus. Intracellulær lokalisering av SeqA-proteinet ble studert ved hjelp av immunmerking og fluorescens mikroskopi. Nivået av DNA-byggesteiner (deoksyribonukleotider) ble funnet ved hjelp av HPLC analyse.
RESULTATER
Studier av en mutant utgave av SeqA-proteinet viste at spesifikke N-terminale vekselvirkninger kreves for at SeqA-proteiner skal binde til hverandre og danne en høyere ordens-struktur (2). In vitro-studier viste at SeqA-proteiner binder til hverandre og danner et venstredreiet filament som kan kveile DNA rundt seg og på denne måten ha evnen til å samle nylig kopiert DNA sammen (2). Dannelsen av en høyere ordensstruktur ble funnet å være nødvendig for at SeqA skal kunne binde til origo oghindre ekstra kopieringer og også for at SeqA skal kunne organisere nylig kopiert DNA på replikasjonsgaffelen (figur 1) (2). Videre ble det funnet at antallet SeqA-strukturer i en celle ikke bestemmes av antallet replikasjonsgafler (3, 4) og at eksisterende SeqA-strukturer trekker til seg nylaget DNA mens kopieringen foregår (3). Studier av celler som inneholdt for få DNA-byggesteiner viste ingen endring i antall SeqA-strukturer i cellen (4). En moderat reduksjon i nivået av DNA-byggesteiner i cellen ble funnet å resultere i langsommere, men korrekt, kopiering av kromosomet og forsinket celledeling (4).
DISKUSJON
SeqA-proteinet har to ulike funksjoner i E. coli-cellen. Ved å binde til nylig kopierte origoer på datterkromosomene hindres ekstra kopieringer av kromosomet innenfor samme cellesyklus. Dette er viktig for å bevare arvestoffet intakt gjennom generasjoner. I tillegg binder SeqA-proteinet til nylig kopiert DNA på replikasjonsgaffelen. I begge tilfeller må mange SeqA-proteiner binde til hverandre og danne et proteinfilament som igjen er bundet til DNA for at SeqA skal kunne utføre sine oppgaver i cellen. Dette proteinfilamentet må være dynamisk da det både er et begrenset antall SeqA-proteiner i cellen og siden replikasjonsgaffelen beveger seg rundt kromosomet etter hvert som kopieringen pågår. Det er ikke kjent hvilken faktor(er) som styrer polymerisering/depolymerisering av proteinfilamentet. SeqA-proteiner bundet til nylig kopiert DNA på replikasjonsgaffelen danner store komplekser i cellen som hvert inneholder mer enn én replikasjonsgaffel. Dette indikerer at SeqA-proteinet har evnen til å samle de nylig kopierte delene av kromosomene sammen og kan ha en rolle i fordelingen av de kopierte kromosomene til hver dattercelle før celledeling. Dette vil være spesielt viktig for en hurtigvoksende celle med overlappende kopieringssykluser der korrekt par av datterkromosomer må fordeles til korrekt par av datterceller. Det er ingen evidens for at SeqA-proteiner bundet til replikasjonsgaffelen holder sammen et stort kompleks bestående av enzymer involvert i syntesen av DNA-byggesteiner og enzymer involvert i kopieringen av kromosomet.
KONKLUSJON
Ulike celletyper, fra bakterier til menneskeceller, har utviklet kontrollmekanismer for å sikre at kromosomene kopieres til rett tid og at de ikke kopieres for ofte eller for sjelden. Selv om de detaljerte mekanismene varierer mellom de ulike celletypene, har de alle det til felles å sikre at arvematerialet bevares intakt gjennom generasjoner. I E. coli-cellen har SeqA-proteinet en viktig rolle som en negativ regulator av kontroll av kopiering av kromosomet. SeqA-proteinets evne til å organisere nylig kopiert DNA på replikasjonsgaffelen kan representere en annen unik rolle for SeqA-proteinet i cellen. Det tyder på at SeqA-proteinet kan være involvert i fordelingen av de kopierte kromosomene til hver dattercelle før celledeling.
Referanser
- Molina F, Skarstad K. Replication fork and SeqA focus distributions in Escherichia coli suggest a replication hyperstructure dependent on nucleotide metabolism. Mol Microbiol 2004; 52:1597–1612.
- Odsbu I, Klungsøyr HK, Fossum S et al. Specific N-terminal interactions of the Escherichia coli SeqA protein are required to form multimers that restrain negative supercoils and form foci. Genes Cells 2005; 10:1039–1049.
- Morigen, Odsbu I, Skarstad K. Growth rate dependent numbers of SeqA structures organize the multiple replication forks in rapidly growing Escherichia coli. Genes Cells 2009; 14:643–657.
- Odsbu I, Morigen, Skarstad K. A reduction in ribonucleotide reductase activity slows down thechromosome replication fork but does not change its localization. PLoS One 2009; 4:e7617.
(Publisert i NFT nr. 2/2010 side 28–29.)
