Hvilke detaljer skal med i søknaden om markedsføringstillatelse?
Hovedbudskap
- Nye prinsipper for kontroll av legemidlers kvalitet er under utvikling. Disse utgjør et attraktivt alternativ til tradisjonell batch-frigivelse basert på sluttkontroll.
- De nye prinsippene kan gi bedre kontroll med kvaliteten og mer effektive produksjonsprosesser.
- Myndighetenes saksbehandling har vært et problem for disse tilfellene, men situasjonen er i ferd med å bedres. Når industrien dokumenterer sin søknad på en god måte, blir saksbehandlingen effektiv
Tekst: Øyvind Holte, forsker, avdeling for legemiddelutredning, Statens legemiddelverk
De siste ti årene har vi sett flere initiativer fra både legemiddelindustrien og myndighetene for innføring av moderne prinsipper for utviklingsarbeid, tilvirkning og kontroll av legemidler. Sentrale begreper er Enhanced approach to development, Quality by Design (QbD), prosessanalytisk teknologi (PAT), Design Space og Real time release testing (RTR-testing). Tatt i betraktning at disse initiativene hadde de beste hensikter, er status for disse ikke helt i tråd med forventningene. Både industrien og myndighetene sliter med å høste fruktene av arbeidet, nemlig en mer effektiv tilvirkning av legemidler og en høyere sikkerhet for at legemidlene har god kvalitet.
Bakgrunn
Tilvirking av legemidler er strengt regulert. Det er gode grunner for dette, herunder tidligere erfaringer med kvalitetssvikt med fatale følger (1). I mange tilfeller er det umulig for pasienten å anslå kvaliteten på sine legemidler, og det er tilvirkers ansvar at frigitte legemidler er av god kvalitet. Legemiddelverket overvåker markedsførte legemidler i Norge gjennom godkjenning av markedsføringstillatelsen (MT). Et viktig element i MT er en detaljert beskrivelse av tilvirkningsprosessen og tilhørende kontroller. Et annet viktig element er den godkjente spesifikasjonen som representerer kvalitetsstandarden for det enkelte legemiddelet. Disse detaljene i MT er bindende for rutineproduksjon, og endringer i MT må søkes til Legemiddelverket etter gjeldende regler.
Det finnes flere alternative strategier for å demonstrere at hvert produksjonsparti overholder spesifikasjonen. Produsentens tilnærming til dette omtales gjerne som kontrollstrategien. Quality by Design (QbD) og Design Space representerer moderne tilnærminger for å sikre og demonstrere ønsket kvalitet av et legemiddel. Et typisk trekk ved QbD er at det legges mindre vekt på sluttesting av produktet ved stikkprøver, og mer vekt på en velkontrollert prosess. Det er imidlertid en utbredt oppfatning at det ligger regulatoriske hindringer i veien for å ta disse prinsippene i bruk. I denne artikkelen diskuteres dette, og det gis råd om hvordan MT-dokumentasjonen bør utformes for å bidra til en effektiv saksbehandling.
The new quality paradigm
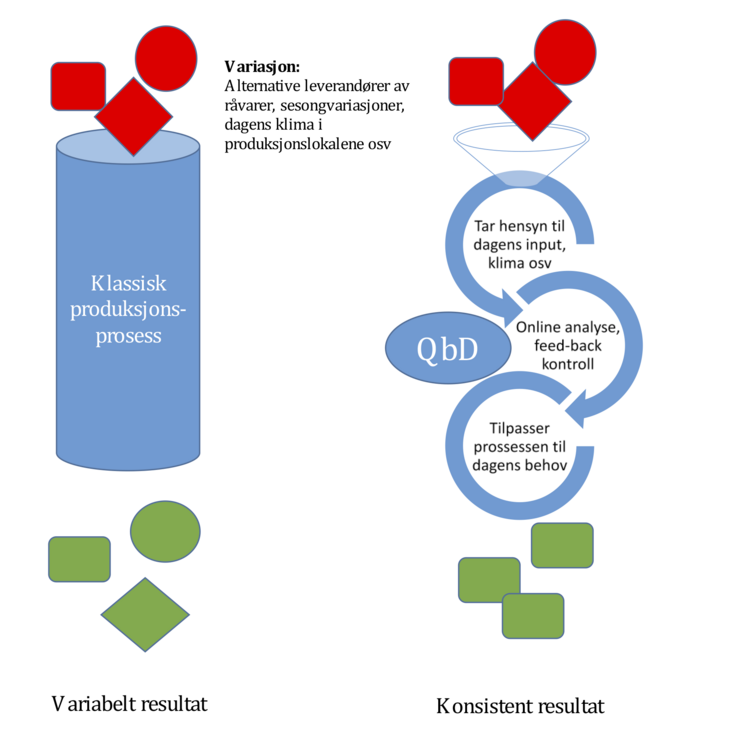
Med utvikling av nye analysemetoder og større datakraft de siste par tiårene, har det oppstått nye muligheter for testing og kontroll i forbindelse med industriell tilvirking av legemidler. Tradisjonell sluttesting med små, «representative» prøver kan erstattes av mer eller mindre kontinuerlig online/inline-overvåkning av produktet under tilvirkningen. Da kan sluttesting bli overflødig for å demonstrere kvaliteten til legemiddelet. Det kan vises at mellomprodukter og sluttprodukter overholder sine forhåndsbestemte kvalitetsstandarder (spesifikasjonen) ved å overvåke at produksjonsprosessen forløper som forventet. Denne tilnærmingen kalles gjerne «det nye kvalitetsparadigmet» (the new quality paradigm), eller Quality by Design. QbD-tilnærmingen åpner for en mer fleksibel beskrivelse av tilvirkningsprosessen i MT: Basert på et såkalt forsterket utviklingsarbeid (enhanced approach to development) kan produsenten vise at legemiddelets kvalitet sikres innenfor et spenn av betingelser (prosessparametere) under tilvirkningen, gjerne på tross av variabel kvalitet (material attributes) av virkestoff og hjelpestoffer (se figur 1): Flere fleksible prosessparametere kan kombineres i et flervariat Design Space som har blitt vist å gi sluttprodukt av god kvalitet. Tilvirkingsprosesser kan også utvikles slik at de aktivt tilpasser seg normal variasjon i råvarenes fysikalske egenskaper eller andre forhold som er vanskelig å kontrollere, for eksempel temperatur og luftfuktighet i lokalene. Dermed får sluttproduktet alltid lik kvalitet selv om betingelser kan variere mellom produksjonspartiene. En annen fordel med godkjent Design Space i MT er at det normalt ikke blir nødvendig å sende like mange endringssøknader knyttet til tilvirkningsprosessen når det allerede gis rom for justeringer innenfor den godkjente beskrivelsen i MT. Et fleksibelt Design Space representerer ikke noe brudd med det etablerte prinsippet om at kvalitet bygges inn i produktet gjennom en robust tilvirkningsprosess. Tvert imot – et godt etablert Design Space vil kunne representere en økt sikkerhet for kvalitet sammenliknet med en prosess der man jobber innenfor stramme, validerte rammer uten å ta hensyn til normal variasjon i betingelser.
Førende retningslinjer
Konseptet prosessanalytisk teknologi (PAT) ble først formalisert av de amerikanske legemiddelmyndighetene (FDA) i 2004 med retningslinjen Guidance for Industry: PAT – A Framework for innovative pharmaceutical development, manufacturing, and quality assurance (2). De viktigste retningslinjene innenfor QbD er ellers en serie ICH-retningslinjer Pharmaceutical development – Q8, Quality Risk management – Q9 og Pharmaceutical Quality System – Q10 (3–5). ICH har også publisert nyttige veiledninger i Q8/Q9/Q10 Questions & Answers, Q8/Q9/Q10 Points to Consider og Q8/Q9/Q10 training (6–8). ICH Q8 var i utgangspunktet avgrenset til å omfatte ferdige legemidler, men de samme konseptene er gyldige også for rene virkestoffer gjennom den nyere retningslinjen Development and Manufacture of Drug Substances – Q11 (9). Det europeiske legemiddelkontoret (EMA), FDA og de japanske legemiddelmyndighetene (NIHS) har publisert ytterligere veiledning, delvis basert på erfaring fra enkeltsøknader, på sine respektive nettsider. Dessuten har både myndigheter og private aktører publisert flere såkalte mock dossiers – fiktive søknader for virkestoffer og ferdige legemidler: Examplain (Efpia, 2006), ACE tablet (Conformia, 2008), A-Mab (Industrigruppering, 2009), Sakura tablet (NIHS, 2009), Example QbD MR Tablet (US FDA, 2011), Example QbD IR Tablet (US FDA, 2012), Sakura Bloom tablet (NIHS, 2014). Formålet med disse dokumentene er å gi illustrerende eksempler på hvordan man kan presentere QbD-basert utviklingsarbeid i søknaden om MT (10).
I og med en nylig revisjon av General notices i den europeiske farmakopeen (2013) er det gjort helt klart at tradisjonell sluttesting i henhold til forskrevne analysemetoder ikke er nødvendig for å demonstrere at det aktuelle stoffet overholder sin farmakopémonografi (11): An article is not of Pharmacopoeia quality unless it complies with all the requirements stated in the monograph. (…) The manufacturer may obtain assurance that a product is of Pharmacopoeia quality on the basis of its design, together with its control strategy and data derived, for example, from validation studies of the manufacturing process. (…) An enhanced approach to quality control could utilise process analytical technology (PAT) and/or real-time release testing (including parametric release) strategies as alternatives to end-product testing alone.
Oppfatninger om regulatoriske hindringer
Det er opp til søker (senere MT-innehaver) å forklare i sin søknad at legemiddelet har gjennomgått en sunn utviklingsprosess, at tilvirkningsprosessen er godt nok kontrollert, og at hvert fremtidig produksjonsparti er av god nok kvalitet. Dette gjelder uavhengig av om det er fulgt en tradisjonell tilnærming til utvikling, tilvirkning og kontroll, eller om det er benyttet noen av QbD-prinsippene. Når formuleringen, tilvirkningsprosessen, kontrollstrategien eller utviklingshistorikken for et legemiddel er komplisert, er det imidlertid mer utfordrende for søkeren å forklare dette for myndighetene slik at legemiddelet kan godkjennes for markedsføring. Det har vist seg at tilvirkningsprosesser beskrevet som Design Space blir nærmere ettergått i sømmene enn tradisjonelt beskrevne prosesser. Myndighetene etterspør ofte flere detaljer om utviklingen av Design Space, noe som kan forsinke eller til og med hindre den endelige godkjenningen av legemiddelet. Når vi husker at selve beskrivelsen av tilvirkningsprosessen nesten alltid er en sentral del av kontrollstrategien for et legemiddel (bygger kvalitet inn i produktet), er det helt naturlig at myndighetene viser interesse for en tilvirkningsprosess som ved første øyekast kan virke uvanlig fleksibel.
Myndighetene og industrien er helt enige om tolkningen av QbD-prinsippene slik de er beskrevet i retningslinjene, og begge sider av bordet erkjenner fordelene ved QbD:
• Stimulerer implementering av innovativ og oppdatert teknologi (både tilvirkning og analyse)
• Gir effektiv utvikling av nye produkter og prosesser (right first time)
• Legger til rette for videre forbedring av prosess og produkt gjennom legemiddelets levetid (Life cycle management)
• Gir økt utbytte (yield) og optimale prosesstider
• Bør føre til færre endringssøknader etter første godkjenning
• Bidrar til færre forkastede produksjonspartier.
På EMAs nettsider finnes en samling eksempler på reelle QbD-baserte søknader (12). Disse ble presentert og diskutert under et fellesmøte med deltakere fra industri og myndigheter i januar 2014. Eksemplene dekker et bredt spekter av problemstillinger og viser hvilken type diskusjoner vi ofte ser i løpet av saksbehandlingen av QbD-baserte søknader.
Råd til industrien
Når det nye legemiddelet inkludert tilvirkningsprosessen har blitt utviklet i henhold til gjeldende regelverk, burde det ikke være noen grunn til at myndighetene skulle avvise kvalitetsdelen av dokumentasjonen (også kalt modul 3 eller CMC). Det viser seg ofte at «urimelige» krav og spørsmål fra myndighetene helt eller delvis skyldes søkers mangelfulle eller uklare presentasjon i søknaden. Det er avgjørende at søker er i stand til å forklare for myndighetene hvordan de sikrer god kvalitet av fremtidige produksjonspartier, spesielt når tilvirkningsprosessen er fleksibel og kontrollstrategien er basert på for eksempel nye analyseprinsipper eller automatiske feedback-/feedforward-mekanismer.
Hvor mye data skal presenteres?
Det er utfordrende å forklare sammen-
hengen mellom ulike elementer av utviklingsarbeidet og kontrollstrategien for QbD-baserte søknader, sammenliknet med tradisjonelle prinsipper for utvikling, tilvirkning og kontroll av legemidler. Det er vanskelig å treffe riktig detaljnivå for å muliggjøre en kritisk gjennomgang av utviklingsarbeidet. Et nyttig sitat fra ICH Q9-retningslinjen lyder: «The level of effort, formality, and documentation of the quality risk management process should be commensurate with the level of risk» (4). ICH Q9 omhandler risikohåndtering, men det samme prinsippet er gyldig for alle elementene i en QbD-basert søknad: Et Design Space som gir stor fleksibilitet for fremtidig tilvirkning, prosessparametere som styres av automatisk feedback fra inline-analyser eller helt ny teknologi ville kreve en mer detaljert beskrivelse av utviklingshistorikken. På den annen side, et Design Space som ikke gir særlig mye mer fleksibilitet enn det som tillates etter tradisjonell beskrivelse av tilvirkningsprosessen, burde det ikke være nødvendig å begrunne med spesielt mye data fra utviklingsarbeidet. I stedet vil det være nyttig om søkeren kan forklare hvorfor de anser prosessbeskrivelsen som ikke særlig revolusjonerende, og hvorfor det ikke var nødvendig å undersøke prosessen mer detaljert. Når et Design Space skal begrunnes, er det også nyttig å klargjøre andre sider ved kontrollstrategien. Et Design Space som er grunnlaget for Real Time Release testing vil være mer kritisk enn et Design Space for et (mellom)produkt som gjennomgår sluttesting. QbD-baserte søknader vil kunne inneholde enorme mengder data og resultater, og det er viktig at søkeren veileder myndighetene gjennom dokumentasjonen sin, slik at det kan fokuseres på det som er mest kritisk.
Hvilken type dokumentasjon skal presenteres?
Søknaden kan støttes av ulike typer dokumentasjon:
• Resultater fra planlagte eksperimenter som ble gjort for å utforske produktet og prosessen
• Henvisninger til erfaring med andre liknende produkter og prosesser
• Vitenskapelig litteratur.
For alle disse tre typene dokumentasjon er det viktig å vise at dataene er relevante for det aktuelle produktet og tilvirkningsprosessen. Planlagte eksperimenter, gjerne som eksperimentelt design (Design of Experiments) gjøres gjerne på liten skala. Da er det viktig å sannsynliggjøre at resultater og trender er relevante også for kommersiell skala. Når det henvises til erfaring med andre produkter må det forklares hvilke forhold som er like eller sammenliknbare med det nye produktet, og hvordan forskjellene er ivaretatt under utviklingen av det nye legemiddelet. Henvisning til vitenskapelig litteratur er ofte relevant når utviklingsarbeidet støttes av en teoretisk modell, for eksempel for å anslå gunstige betingelser for en prosess. Det er vanligvis nødvendig å bekrefte de teoretiske anslagene med eksperimenter for å vise at den teoretiske modellen var relevant for produktet.
Presentasjon av flervariate eksperimentelle data
Det kan være utfordrende å vise resultater fra flervariate eksperimenter på en god måte. De viktigste resultatene skal trekkes frem samtidig som man ikke går glipp av relevant informasjon. Regresjonskurver eller tredimensjonale regresjonsplan kan oppsummere hovedfunnene i et flervariat datasett, men det bør også oppgis parametere som anslår usikkerheten i resultatene. For en tradisjonell enkelt måleserie med flere paralleller av hvert eksperiment angis gjerne usikkerheten som standardavvik eller maksimums- og minimumsverdier. For flervariate analyser (noen ganger omtalt som kjemometri) finnes flere ulike mål for usikkerhet, delvis avhengige av programvaren som er brukt i beregningene. Et godt anslag på usikkerheten i analysen er viktig for å vurdere i hvilken grad resultatene kan forutsi (predikere) egenskapene til fremtidige produksjoner, og ikke bare beskrive historiske resultater (korrelasjon, regresjon).
Bruk etablert terminologi
Ordlisten i ICH Q8-retningslinjen etablerte flere begrep og termer som er vanlige å bruke i beskrivelsen av QbD-tilnærminger og Design Space (3). Det bidrar til en god vurdering av søknaden dersom disse begrepene brukes som forklart i ICH Q8. Hvis det er nødvendig å bruke andre begreper i tillegg, for eksempel begreper som er etablert internt i firmaet, er det viktig at disse er godt forklart. Begreper som «key process parameter» og «key quality attribute» har skapt problemer for godkjenningsprosesser, ettersom det er vanskelig å forstå betydningen av disse sammenliknet med de definerte «critical process parameter» og «critical quality attribute» (ICH Q8). Etablerte begreper som «proven acceptable range» (PAR; et fleksibelt spenn av betingelser) har vi sett brukt på en annen måte enn ICH Q8 beskriver, for eksempel ved at flere prosessparametere i samme prosess er angitt med PAR. Slik flervariat-fleksibilitet skal ikke beskrives som PARer, men heller som Design Space i henhold til retningslinjene. For myndighetene er det ekstra forvirrende at hvert firma kan ha sitt eget sett med intern terminologi, og kan bruke de etablerte begrepene på sin egen måte. Feil bruk av terminologi har ført til mange oppklaringsspørsmål de siste årene, noe som kan ha forsinket eller i verste fall hindret godkjenning av legemiddelet.
Konklusjon
De nye prinsippene for utvikling og kontroll av legemidler og tilvirkningsprosesser som gjerne kalles the new quality paradigm (beskrevet i retningslinjene ICH Q8–11) er helt akseptable. Det er likevel utfordrende både for industrien og myndighetene å håndtere søknader om godkjenning av legemidler som er utviklet og kontrollert på denne måten. Søker må være bevisst på hvilken mengde data og hvilket detaljnivå som presenteres i søknaden. Som et generelt prinsipp skal nivået på dokumentasjonen av utviklingsarbeid og prosessbeskrivelse (mengde og detaljnivå) samsvare med hvilken rolle de spiller i kontrollstrategien: Utviklingsarbeid som leder til et fleksibelt Design Space vil kreve mer dokumentasjon enn utviklingsarbeid som leder til en tradisjonell, innskrenket tilvirkningsprosess. Nye, banebrytende analysemetoder og prinsipper vil kreve en nærmere beskrivelse enn tradisjonelle metoder. Sentrale deler av den samlede kontrollstrategien vil kreve grundig forklaring. På den annen side skal myndighetene være tydelig på hvorfor de stiller spørsmål til innsendt søknad. Dette vil bidra til en god forståelse hos begge parter, og bør føre til at de moderne prinsippene for å sikre god kvalitet av legemiddelet kan tas i bruk for de legemidlene der det er fornuftig.
REFERANSER:
1. Johnston A, Holt DW. «Substandard drugs: a potential crisis for public health», Br J Clin Pharmacol 2014; 78: 218–43.
2. Food and Drugs Administration. «Guidance for Industry: PAT – A Framework for innovative pharmaceutical development, manufacturing, and quality assurance» (2004).
3. ICH. «Guidance for Industry Q8(R2) Pharmaceutical Development» (2009).
4. ICH. «Guidance for Industry Q9 Risk Management» (2006).
5. ICH. «Guidance for Industry Q10 Pharmaceutical Quality System» (2008).
6. ICH. «Quality Implementation Working Group on Q8, Q9 and Q10 Questions and Answers (R4)» (2010).
7. ICH. «Quality Implementation Working Group Points to Consider (R2)» (2011).
8. ICH Training Programme for Q8/Q9/Q10:
www.ich.org/products/guidelines/quality/training-programme-for-q8q9q10.html
(søkedato 15.02.2016).
9. ICH. «Guidance for Industry Q11 Development and Manufacture of Drug Substances» (2012).
10. pharmaQbD: www.pharmaqbd.com/qbd_guidance/ (søkedato 15.02.2016).
11. Council of Europe, Strasbourg Cedex, France. 1. General notices, in European Pharmacopoeia (curr.ed).
12. EMA website on Quality by Design:
www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/document_listing/document_listing_000162.jsp&mid=WC0b01ac058076ed73 (søkedato 15.02.2016).
(Publisert i NFT nr 3/2016 side 22-24)
