Dikloracetat (DCA) som kreftbehandling
Tekst: Guttorm Raknes, lege, RELIS Nord-Norge
BUDSKAP
- Dikloracetat (DCA) har blitt fremstilt som en effektiv, trygg og billig behandling av flere kreftformer.
- Leger og farmasøyter bør være oppmerksomme på at egenbehandling med DCA finner sted.
- DCA kan gi perifer nevropati.
- Basert på tilgjengelig evidens, kan DCA ikke anbefales brukt utenom i kliniske studier.
RELIS får ofte spørsmål om effekten av ulike alternative kreftbehandlinger. Det meste viser seg fort useriøst eller uvirksomt, men en sjelden gang dukker det opp behandlinger som ikke uten videre kan avfeies.
Dikloracetat (dikloreddiksyre, DCA) har i flere år blitt brukt av kreftpasienter som selvmedisinering og off label i regi av leger. Etter å ha blitt omtalt som en enkel, billig, ufarlig og effektiv behandling av en rekke kreftformer i en reportasje i det anerkjente populærvitenskapelige tidsskriftet New Scientist i 2007 (1), har DCA fått en betydelig tilhengerskare. RELIS har utredet spørsmål om DCA tre ganger (2–4).
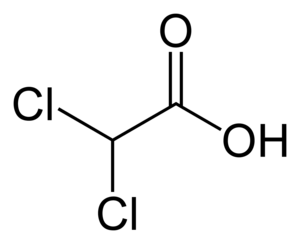
Hva er DCA?
Dikloracetat er et eddiksyremolekyl hvor to av hydrogenatomene er byttet ut med klor (se figur 1). DCA finnes ikke naturlig, men kan oppstå spontant i kontakt mellom klorert drikkevann og organiske forbindelser.
DCA har tilnærmet 100 % peroral biotilgjengelighet. Siden det er et lite molekyl, trenger det lett inn i de fleste typer vev, også i sentralnervesystemet. Halveringstiden ved første dose er mindre enn en time, men DCA ser ut til å hemme sin egen metabolisme slik at halveringstiden øker til mange timer ved gjentatt dosering (5). Typiske doser er 10–35 mg/kg.
Postulert virkningsmekanisme
Kreftceller, nærmest uansett type, ser ut til å foretrekke anaerob metabolisme, det vil si glykolyse fulgt av melkesyrefermentering (laktatproduksjon) i cytosol fremfor den langt mer effektive utnyttelsen av glukose gjennom oksydativ fosforylering i mitokondriene (sitronsyresyklusen). Dette kalles Warburg-effekten, og er et potensielt angrepspunkt for legemidler med bred virkning mot flere krefttyper (6).
Populært sagt virker DCA ved å «skru på» mitokondriene. Ved å hemme enzymet pyruvat dehygrogenase kinase sørger DCA for at mer pyruvat blir tilgjengelig for oksydativ forsforylering. Metabolismen vris over fra glykolyse i cytosol til vanlig aeorob metabolisme i mitokondriene, og dette skal blant annet bidra til økt apoptose i kreftceller. Effektene på mitokondriene er bakgrunnen for at de amerikanske legemiddelmyndighetene (FDA) har godkjent bruk av DCA ved enkelte medfødte mitokondriesykdommer. Resultatene fra kliniske studier på medfødt laktacidose har imidlertid vært skuffende. Behandlingen bidrar til lavere laktatnivåer i blodet, men effektene på livskvalitet og overlevelse har ikke kunnet oppveie bivirkningene (7–9).
I cellekulturer har forskere observert apoptose indusert av DCA i blant annet ikke-småcellet lungekreft (10), endometrie (11)- og prostatakreft (12). DCA har i en studie på rotter vist seg å hemme vekst av lungekreft (10).
Kliniske studier
Det er ikke utført randomiserte, dobbeltblindete studier på bruk av DCA, og publiserte data på bruk ved kreft i pasienter er generelt svært begrenset.
Mest oppmerksomhet har blitt viet en kanadisk studie hvor DCA ble gitt til fem pasienter med av glioblastoma multiforme, en agressiv form for hjernekreft hvor det ikke er gode behandlingsalternativer. Pasientene fikk 12,5 mg/kg DCA to ganger daglig i en måned før dosen ble doblet. DCA kom i tillegg til annen behandling (kirurgi, stråling, cellegift). En av pasientene døde etter tre måneder, mens fire fremdeles var i live uten tegn til progresjon av tilstanden etter 15 måneder. En av pasientene brukte utelukkende DCA de siste ni månedene, og i den perioden viste MR at gjenværende tumormasser etter kirurgi og strålebehandling gikk helt tilbake. Pasienten forble asymptomatisk (13). Samlet sett er behandlingsresultatet fra disse fem pasientene forbløffende godt, men det er usikkert om effekten kan tilskrives DCA eller den andre behandlingen pasientene fikk.
I en nylig publisert åpen fase II-studie tok forfatterne sikte på å rekruttere 29 pasienter med metastatisk brystkreft eller avansert ikke-småcellet lungekreft. De lyktes bare å rekruttere sju pasienter, hvorav bare én hadde brystkreft. Pasientene fikk 6,25 mg/kg DCA inntil forverring radiologisk, uakseptable bivirkninger eller død. To av pasientene døde plutselig innen en uke etter oppstart med DCA. Dødsårsak var hos den ene akutt lungeemboli og den andre ukjent, og det er ifølge forfatterne usikkert om disse dødsfallene kan knyttes til DCA. Brystkreftpasienten hadde stabil sykdom i to måneder, inntil hun utviklet hjernemetastaser. To av lungekreftpasientene trakk seg fra studien, og to hadde forverring av sykdommen. Studien ble avbrutt tidligere enn planlagt på grunn av utfallene. Forfatternes konkluderte med at DCA ikke er egnet som monoterapi ved ikke-småcellet lungekreft (14).
Flere enkeltpasienter hevdes å ha blitt helbredet fra kreftsykdom av DCA. Et særlig godt dokumentert tilfelle er en pasient som nektet videre cellegift etter å ha fått residiv av non-Hodgkin lymfom etter gjennomgått standardbehandling (rituxmab-CHOP). Pasienten valgte heller egenbehandling hvor 1000 mg DCA daglig stod sentralt. Kort tid etter oppstart gikk tumormassene tilbake, og pasienten ble etter hvert helt frisk. Pasienten ble fulgt med flere PET-scanninger. Siste dokumenterte kontroll 4,5 år etter oppstart med DCA viste ingen tegn til kreft (15). En annen kasuistikk beskriver en 72 år gammel pasient med metastatisk nyreplateepitelkarsinom som brukte DCA i tillegg til palliativ strålebehandling. Da pasienten etter tre måneder måtte seponere DCA på grunn av polynevropati, viste undersøkelse at metastasene var forsvunnet. CT fire år senere viste ingen tegn til tilbakefall (16). Denne kreftformen regnes vanligvis for uhelbredelig (17).
Ifølge clinicaltrials.gov er en placebokontrollert studie på bruk av DCA i tillegg til cisplatin ved plateepitelkarsinom i hode-/halsområdet igangsatt. Resultater fra denne studien foreligger foreløpig ikke.
Bivirkninger/tokisitet
DCA fremstilles av tilhengerne som en kreftbehandling med få bivirkninger. Det er imidlertid klart at DCA gir skader på perifere nerver. En studie hvor DCA ble brukt ved medfødt mitokondriesykdom (MELAS) hos barn måtte avbrytes tidlig på grunn av høy forekomst av nytilkommet eller forverret perifer nevropati (7). Det er også rapportert om alvorlig encefalopati ved bruk av DCA hos en pasient med malignt melanom (18). Polynevropati er en vanlig bivirkning av flere cytostatika, og hos kreftpasienter kan det derfor være vanskelig å avgjøre om bivirkningen skyldes DCA eller annen behandling. Forsøk i rotte har vist at DCA har karsinogene effekter, også ved eksponeringer per kroppsvekt tilsvarende det som er brukt i kliniske studier (19). I behandling av kreft er dette ofte underordnet, og flere kreftlegemidler har kreftfremkallende virkninger.
Etiske og juridiske utfordringer
Oppmerksomheten rundt DCA som en mulig universalkur mot kreft har ført til krav fra mange pasienter om å få behandlingen. DCA er et relativt lett tilgjengelig kjemikalium, og enkelte pasienter skaffer seg dette på egen hånd for selvmedisinering. Flere nettsider tilbyr reseptfrie DCA-preparater til bruk for egen risiko. Flere etiske problemstillinger reiser seg, noe blant annet redaksjonen i Nature har omtalt (20). Det blir ekstra utfordrede å rekruttere pasienter til kliniske studier når behandlingen er så billig, lett tilgjengelig og tilsynelatende effektiv. De aktuelle pasientene har som regel langtkommen kreftsykdom, og har ikke tid til å vente på kliniske studier. Faren for bivirkninger og skadelige langtidseffekter er dessuten underordnet.
For nyutviklede legemidler er dette ikke noe problem da store og godt gjennomførte kliniske studier er nødvendig for i det hele tatt å få markedstilgang. For legemidler som er tilgjengelige for andre formål og hvor patentet er gått ut, kan det derimot bli svært vanskelig å få dokumentert nye indikasjoner innen onkologi. Så langt har det vært et viktig prinsipp at leger skal ha anledning til forskrive legemidler utenfor indikasjon. Historien om DCA reiser spørsmål om myndighetene i enkelte tilfeller bør gripe inn og begrense bruken av off label-behandling inntil nødvendige placebokontrollerte studier er på plass.
I Norge har ingen DCA-preparater hatt markedsføringstillatelse. Enkelte av studiene på DCA kan muligens gi grunnlag for registreringsfritak i Norge, men vi kjenner ikke til om Legemiddelverket har behandlet noen søknader om dette. Enkeltpersoner kan bestille natrium-dikloracetat-pulver med høy grad av renhet fra kjemikalieforhandlere med tanke på inntak på eget initiativ og risiko.
OPPSUMMERING
DCA har ukritisk blitt fremstilt som en trygg, effektiv og billig universalmedisin mot mange vanlige kreftformer. Behandlingen har fått stor oppmerksomhet utenfor etablerte fagmiljøer, og det er grunn til å tro at både leger og farmasøyter vil komme i kontakt med pasienter som driver egenbehandling med DCA.
Det teoretiske grunnlaget for at DCA kan ha effekt ved kreft er til en viss grad plausibelt, og det foreligger oppløftende resultater fra flere studier i dyr og i cellekulturer. Likevel er dokumentasjonen fra kliniske studier så svak at det ikke er grunnlag for å anbefale behandlingen i vanlig klinisk praksis. Studier med kontrollgruppe finnes ikke. I enkelte tilfeller kan det ikke utelukkes at DCA har bidratt til helbredelse av kreft, men det er også studier som antyder at behandlingen kan ha alvorlige bivirkninger. Det er liten tvil om at DCA kan gi perifer nevropati.
Tilgjengelig dokumentasjon tyder på at man ikke kan avvise at DCA kan ha en rolle ved behandling av kreft i tillegg til annen standardbehandling. For å avklare dette må større randomiserte, dobbeltblindete placebokontrollerte gjennomføres. På grunn av liten kommersiell interesse og vanskeligheter med å rekruttere pasienter, er det lite sannsynlig at nødvendige kliniske studier vil bli gjennomført.
Referanser
- Coghlan A. Cheap, 'safe' drug kills most cancers. www.newscientist.com/article/dn10971-cheap-safe-drug-kills-most-cancers.html. (Lest 16.09.2014).
- RELIS database 2007; spm.nr. 2415, RELIS Midt-Norge
- RELIS database 2009; spm.nr. 3154, RELIS Midt-Norge
- RELIS database 2009; spm.nr. 1972, RELIS Nord-Norge
- Stacpoole PW. The pharmacology of dichloroacetate. Metabolism 1989; 38: 1124–44.
- Michelakis ED, Webster L et al. Dichloroacetate (DCA) as a potential metabolic-targeting therapy for cancer. Br J Cancer 2008; 99: 989–94.
- Kaufmann P, Engelstad K et al. Dichloroacetate causes toxic neuropathy in MELAS: a randomized, controlled clinical trial. Neurology 2006; 66: 324–30.
- Stacpoole PW, Nagaraja NV et al. Efficacy of dichloroacetate as a lactate-loering drug. J Clin Pharmacol 2003; 43: 683–91.
- Pfeffer G, Majamaa K et al. Treatment for mitochondrial disorders. Cochrane Database of Systematic Reviews 2012, Issue 4. Art. No.: CD004426.
- Bonnet S, Archer SL et al. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth. Cancer Cell 2007; 11: 37–51.
- Wong JY, Huggins GS et al. Dichloroacetate induces apoptosis in endometrial cancer cells. Gynecol Oncol 2008; 109: 394–402.
- Cao W, Yacoub S et al. Dichloroacetate (DCA) sensitizes both wild-type and over expressing Bcl-2 prostate cancer cells in vitro to radiation. Prostate 2008; 68: 1223–31.
- Michelakis ED, Sutendra G et al. Metabolic modulation of glioblastoma with dichloroacetate. Sci Transl Med 2010; 2: 31ra34.
- Garon EB, Christofk HR et al. Dichloroacetate should be considered with platinum-based chemotherapy in hypoxic tumors rather than as a single agent in advanced non-small cell lung cancer. J Cancer Res Clin Oncol 2014; 140: 443–452.
- Strum SB, Adalsteinsson O et al. Case report: Sodium dichloroacetate (DCA) inhibition of the «Warburg Effect» in a human cancer patient: complete response in non-Hodgkin's lymphoma after disease progression with rituximab-CHOP. J Bioenerg Biomembr 2013; 45: 307–15.
- Khan A. Case Report of Long Term Complete Remission of Metastatic Renal Squamous Cell Carcinoma after Palliative Radiotherapy and Adjuvant Dichloroacetate. Advances in Cancer: Research & Treatment 2012; 2012: 441895.
- Holmäng S, Lele SM et al. Squamous cell carcinoma of the renal pelvis and ureter: incidence, symptoms, treatment and outcome. J Urol. 2007; 178: 51–6.
- Brandsma D, Dorlo TP et al. Severe encephalopathy and polyneuropathy induced by dichloroacetate. J Neurol 2010; 257: 2099–100.
- DeAngelo AB, Daniel FB et al. The carcinogenicity of dichloroacetic acid in the male Fischer 344 rat. Toxicology 1996; 114: 207–21.
- Pearson H. Cancer patients opt for unapproved drug. Nature 2007; 446: 474–5.
(Publisert i NFT nr. 10/2014 side 29–30.)
