IMPDH: Målenzymet for det immundempende legemidlet mykofenolat
Doktoravhandling
Tittel
Inosine Monophosphate Dehydrogenase:
The Molecular Target of Mycophenolate
Elektronisk versjon: www.duo.uio.no
Emne
Farmakologi
Stipendiat
Sara Bremer, Avdeling for medisinsk biokjemi, Oslo universitetssykehus HF, Rikshospitalet og Institutt for klinisk biokjemi, Universitetet i Oslo
sara.bremer@rikshospitalet.no
Veiledere
Stein Bergan, Avdeling for farmakologi, Oslo universitetssykehus HF, Rikshospitalet og Farmasøytisk institutt, UiO
Helge Rootwelt, Avdeling for medisinsk biokjemi, Oslo universitetssykehus HF, Rikshospitalet
Forsvar av oppgaven
2009, høst
Hovedbudskap
Sanntids revers transkripsjon (RT)-PCR teknikk muliggjør spesifikk analyse av to nært beslektede IMPDH-isoenzymer.
Høyt genuttrykk av IMPDH2 er assosiert med risiko for transplantatavstøtning.
Legemidler som mykofenolat og kortikosteroider påvirker genuttrykket av både IMPDH1 og IMPDH2. Dette kan igjen ha betydning for mykofenolateffekt og monitorering basert på IMPDH-aktivitet.
Sara Bremer
Avdeling for medisinsk biokjemi, Oslo universitetssykehus HF, Rikshospitalet og Institutt for klinisk biokjemi, Universitetet i Oslo
E-post: sara.bremer@rikshospitalet.no
BAKGRUNN OG HENSIKT
Etter organtransplantasjon er det nødvendig med livslang immundempende behandling for å unngå avstøtning av det transplanterte organet. Behandlingen består vanligvis av et regime med tre–fire legemidler med forskjellige virkningsmekanismer. For svak immundemping gir risiko for organavstøtning, mens for sterk immundemping er forbundet med komplikasjoner som infeksjoner, kreftutvikling og legemiddelspesifikke bivirkninger.
Mykofenolat inngår nå i de fleste behandlingsregimene etter transplantasjon og brukes også i økende grad ved autoimmun sykdom. Legemidlet virker immundempende ved å hemme enzymet inosinmonofosfat dehydrogenase (IMPDH). Dette enzymet katalyserer det hastighetsregulerende trinnet i nysyntesen av deoksyguanin- og guaninnukleotider som blant annet inngår som byggesteiner i DNA og RNA (figur 1A). Lymfocytter er spesielt avhengige av purinnukleotid nysyntese for å proliferere, og IMPDH-hemming vil derfor redusere deres evne til å angripe det fremmede organet.
Enzymaktiviteten til IMPDH utøves av to nært beslektede isoenzymer, IMPDH1 og IMPDH2, som begge består av 514 aminosyrer med 84 prosent sekvenshomologi. Isoenzymene kodes av ulike gener, og uttrykket av disse varierer mellom forskjellige celletyper. De spesifikke funksjonene og reguleringsmekanismene til isoenzymene er i liten grad kartlagt. Det er rapportert at mykofenolat gir fire til fem ganger mer potent hemming av IMPDH2 enn IMPDH1 (1).
Farmakokinetikken til mykofenolat er svært variabel og kan påvirkes av andre legemidler som for eksempel ciklosporin. I tillegg er det rapportert store forskjeller i basale IMPDH-nivåer mellom individer, samt IMPDH-endringer over tid hos den enkelte (2). Mange pasienter må avbryte behandlingen som følge av bivirkninger, og underdosering øker risiko for avstøtning. Man ønsker derfor å individualisere mykofenolatbehandlingen for å redusere risiko for avstøtning og alvorlige bivirkninger. Mulige strategier kan være å styre mykofenolat-doseringen basert på farmakokinetiske, farmakodynamiske eller farmakogenetiske parametre (figur 1B). Det er imidlertid ikke etablert noen optimal strategi for monitorering av dette legemidlet ennå.
Mykofenolatmonitorering basert på farmakodynamiske parametre vil trolig reflektere den kliniske responsen bedre enn ved bruk av farmakokinetiske parametre. En farmakodynamisk strategi kan være å styre mykofenolat-doseringen ut fra den enkeltes IMPDH-nivå (figur 1B). Dette krever imidlertid bedre kunnskap om forholdet mellom mykofenolat, målenzymet IMPDH og responsen hos den enkelte pasient.
Formålet med denne doktorgradsavhandlingen har vært å studere reguleringen av de to IMPDH-isoenzymene under mykofenolatbehandling. Det første prosjektet bestod av utvikling og validering av en metode for kvantifisering av IMPDH1- og IMPDH2-genuttrykk. Metoden ble så benyttet i de påfølgende prosjektene som omfatter gjennomføringen av tre deskriptive kliniske studier med fokus på IMPDH-regulering.
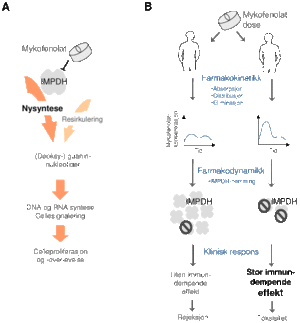
Figur 1.
A: Enzymet inosinmonofosfat dehydrogenase (IMPDH) katalyserer det hastighetsregulerende trinnet i nysyntesen av guanin- og deoksyguaninnukleotider. Mykofenolat hemmer IMPDH og dermed proliferasjonen av lymfocytter som er spesielt avhengige av nysynteseveien.
B: Mykofenolats farmakokinetikk ogfarmakodynamikk varierer i stor grad mellom individer. Dette kan igjen ha betydning for klinisk respons og støtter bruk av farmakologisk monitorering.
MATERIALE OG METODE
To av studiene inkluderte pasienter som var blitt godkjent for nyretransplantasjon ved Oslo universitetssykehus, Rikshospitalet. Det ble tatt blodprøver av pasientene på gjentatte tidspunkter før og inntil 13 uker etter transplantasjon. Den første studien undersøkte pasienter både med (n=25) og uten (n=5) mykofenolatbehandling. Pasientene i den andre studien (n=7) fikk mykofenolat i kombinasjon med ciklosporin eller belatacept (klinisk utprøvning; fase III). Den tredje studien involverte friske personer (n=5) som fikk enkeltdoser med mykofenolat (100–1000 mg).
IMPDH-analysene ble gjort i fullblod og isolerte blodcellepopulasjoner (CD4+ celler og retikulocytter). For spesifikk kvantifisering av IMPDH1- og IMPDH2-genuttrykk ble det utviklet og validert en sanntids revers transkripsjon (RT) PCR-metode (3). Enzymaktiviteten til IMPDH og konsentrasjonen av purinnukleotider ble målt ved hjelp av væskekromatografi (HPLC-UV), mens karakterisering av lymfocyttpopulasjoner ble gjort med væskestrømscytometri. Konsentrasjonen av legemidlene mykofenolat og ciklosporin/takrolimus ble bestemt i henholdsvis plasma og fullblod ved bruk av væskekromatografi og immunokjemiske analysemetoder.
Forskjeller mellom og innen grupper ble testet med ikke-parametriske metoder og regnet som signifikante ved P-verdier under 0,05 (tosidig test).
RESULTATER
Resultatene viser at genuttrykket av begge IMPDH-isoformene, samt IMPDH-enzymaktiviteten, påvirkes av flere faktorer som status i immunforsvaret og behandling med ulike legemidler. Vi fant at IMPDH2-genuttrykket i CD4+ celler før transplantasjon var høyere hos pasienter med avstøtning sammenliknet med pasienter uten avstøtning (median 1,26 versus 0,87, P=0,017; figur 2)(2).
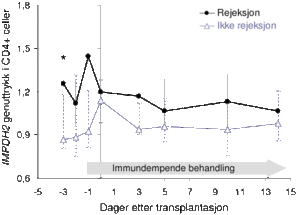
Figur 2. Høyere relativt IMPDH2-uttrykk i CD4+ celler fra pasienter med avstøtning (n=11) sammenliknet med pasienter uten avstøtning (n=19). Det var signifikant forskjell mellom gruppene før transplantasjon (*P=0,017, Mann-Whitney test). Etter transplantasjon var genuttrykket også påvirket av den immundempende behandlingen. Grafen viser median, minimums- og maksimumsverdier for genuttrykk.
Mykofenolat førte til konsentrasjonsavhengige endringer av genuttrykket, særlig av IMPDH1, hos både friske personer og pasienter (2;4;5). Studiene viste også at IMPDH-reguleringen endret seg med tiden etter transplantasjon. De første ukene observerte vi primært en reduksjon av IMPDH-aktiviteten etter inntak av mykofenolat. I motsetning til denne enzymhemmingen fant vi en økning av både IMPDH-aktivitet og genuttrykk etter dose hos de samme pasientene 13 uker etter transplantasjon (4). Vi observerte et inverst forhold mellom IMPDH1-genuttrykket og konsentrasjonen av guaninnukleotider (5).
I tillegg til effekten mediert av mykofenolat fant vi at høye doser kortikosteroider, gitt i forbindelse med transplantasjonen og ved avstøtningsepisoder,påvirket genuttrykket av IMPDH1 og IMPDH2. Denne reguleringen var avhengig av celletype og isoform (2).
DISKUSJON
Bruk av sanntids RT-PCR-teknikk muliggjør spesifikk analyse av de to nært beslektede IMPDH-isoenzymene og gir informasjon om reguleringen av disse på mRNA-nivå (3).
Aktivering og proliferasjon av immunceller er forbundet med en betydelig økning av IMPDH-aktiviteten, og IMPDH-nivået kan trolig fungere som en surrogatmarkør for cellulær immunstatus. Høyere IMPDH2-genuttrykk hos pasientene med avstøtning kan skyldes en høyere grad av immunaktivering hos disse pasientene. Tidligere transplantasjoner, blodoverføringer, graviditeter, dialyse og infeksjoner er faktorer som kan ha betydning for pasientens immunstatus.
Studiene viste videre at IMPDH reguleres på mRNA-nivå under immundempende behandling. Mykofenolats hemming av IMPDH påvirker den intracellulære guaninnukleotid-konsentrasjonen (figur 1A), og dette kan igjen føre til de observerte endringer i IMPDH-genuttrykk (5;6). Kortikosteroider påvirker uttrykket av en rekke gener som er involvert i immunologiske prosesser. Det er sannsynlig at kortikosteroider også fører til direkte og/eller indirekte regulering av IMPDH-genene. Forandringer i genuttrykk kan videre påvirke enzymaktiviteten og bidra til den variable responsen som ble observert for IMPDH under mykofenolatbehandling.
Tidligere ble det antatt at IMPDH1 var konstitutivt uttrykt, mens IMPDH2 var den induserbare isoformen. Vi fant imidlertid signifikant regulering av begge isoformene hos både friske personer og pasienter. Interessen rundt de to IMPDH-isoenzymene er økende og endret regulering og funksjon av disse har blitt assosiert med sykdommer som kreft og øyesykdommen retinitis pigmentosa. Hemmere av IMPDH er i klinisk bruk som immundempende og antivirale legemidler og undersøkes også i forbindelse med kreftbehandling.
En begrensning med funnene våre er det relativt lave antallet deltakere i studiene. Resultatene må derfor bekreftes i større prospektive studier.
KONKLUSJON
Arbeidet har bidratt med kunnskap om de to IMPDH-isoenzymene som er nyttig både for forståelsen av mykofenolats effekt og for utvikling av en strategi for individualisering av mykofenolatbehandlingen. Kunnskap om IMPDH-reguleringen er også viktig innen antiviral- og kreftbehandling, samt for utvikling av nye IMPDH-hemmere.
Referanser
- Carr SF, Papp E, Wu JC et al. Characterization of human type I and type II IMP dehydrogenases. J Biol Chem 1993;268(36):27286–90.
- Bremer S, Mandla R, Vethe NT et al. Expression of IMPDH1 and IMPDH2 After Transplantation and Initiation of Immunosuppression. Transplantation 2008;85(1):55–61.
- Bremer S, Rootwelt H, Bergan S. Real-time PCR determination of IMPDH1 and IMPDH2 expression in blood cells. Clin Chem 2007;53(6):1023–9.
- Bremer S, Vethe NT, Rootwelt H et al. Mycophenolate pharmacokinetics and pharmacodynamics in belatacept treated renal allograft recipients – a pilot study. J Transl Med 2009;7:64.
- Bremer S, Vethe NT, Rootwelt H et al. Expression of IMPDH1 is regulated in response to mycophenolate concentration. Int Immunopharmacol 2009;9(2):173–80.
- Vethe NT, Bremer S, Rootwelt H et al. Pharmacodynamics of Mycophenolic Acid in CD4+ Cells: A Single-Dose Study of IMPDH and Purine Nucleotide Responses in Healthy Individuals. Ther Drug Monit 2008;30(6):647–55.
(Publisert i NFT nr. 2/2010 side 26–27.)
