Calcineurinhemmer-fri immunsuppresjon hos nyretransplanterte pasienter med lav immunologisk risiko
Anders Åsberg1, 2, Karsten Midtvedt1, Pål-Dag Line3,
Janicke Narverud1, Hallvard Holdaas1, Trond Jenssen1,
Anna Varberg Reisæter1
1. Nyrefysiologisk laboratorium, Medisinsk avdeling, Rikshospitalet, Oslo
2. Avdeling for farmasøytisk institutt, Universitetet i Oslo
3. Kirurgisk avdeling, Rikshospitalet, Oslo
Bakgrunn
Takket være moderne immunsuppremerende legemidler har korttidsresultatene av nyretransplantasjon blitt vesentlig bedre og et år etter transplantasjon er graftoverlevelsen over 90% (1, 2). Dessverre er ikke langtidsoverlevelsen forbedret i samme grad (3, 4). Nyretransplanterte pasienter dør prematurt, hovedsakelig på grunn av hjerte-karlidelser og kreft (2, 5-8).
Calcineurinhemmere (CNI; ciklosporin A og takrolimus) er potente immundempende legemidler og viser god effekt når det gjelder å minske risikoen for å få en akutt rejeksjon. Dessverre har CNI mange bivirkninger, som nefrotoksisitet, økt blodtrykk, økte blodlipider, nedsatt glukosetoleranse. Disse bivirkningene er medvirkende årsaker til den økte kardiovaskulære risikoen og vil påvirke langtidsoverlevelsen negativt hos disse pasientene. Samtidig er overimmunsuppresjon et problem som øker risikoen for at en pasient utvikler kreft (9). På den andre siden er akutte rejeksjoner etter nyretransplantasjon en risikofaktor for nedsatt nyrefunksjon (10-12), som i seg selv er en risikofaktor for mortalitet (13).
For å øke pasientoverlevelsen må den immundempende behandlingen balanseres slik at de får få akutte rejeksjoner samtidig som kardiovaskulær- og onkologisk risiko minimeres. Hovedmålsettingen med denne prospektive, åpne, randomiserte, parallellgruppestudien (14) var å undersøke effekten av CNI-fri immunsuppresjon på nyrefunksjon (51Cr-EDTA clearance) gjennom det første året etter transplantasjon. Sekundære endepunkter omfattet effekter på blodtrykk, blodlipider, blodglukose, infeksjoner, akutte rejeksjoner og andre ordinære sikkerhetsparametere.
Pasienter og metoder
Femtifire pasienter med lav immunologisk risiko (førstegangstransplanterte, ikke sensitiverte pasienter som fikk DR-forlikelig nyre fra nekrodonor) ble inkludert konsekutivt over en toårsperiode ved Rikshospitalet. De ble randomisert til enten å få daclizumab + mykofenolat mofetil (høy dose) + prednisolone (Dac-gruppe) eller standardbehandlingen ved Rikshospitalet som består av ciklosporin A + mykofenolat mofetil + prednisolone (CsA-gruppe) før de ble transplantert.
Pasientene ble fulgt opp ukentlig den første måneden, annenhver uke frem til tre måneder etter transplantasjon og deretter ved seks og 12 måneder. Endepunktundersøkelsene ble utført henholdsvis 10 uker og 12 måneder etter transplantasjon.
En utvalgsstørrelse på 35 pasienter i hver gruppe var beregnet å gi en styrke på 80% ved bruk av et 5 prosentisk signifikansnivå. Utregningen er basert på en forventet 25% relativ forskjell i forandring av nyrefunksjon mellom uke 10 og måned 12 og et frafall på 30%. I den statistiske analysen ble grupper sammenliknet ved å bruke uparet Students t-test for kontinuerlige variable og med χ2-analyse for kategoriske variabler og med logistisk regresjon for tidsavhengige variabler. SPSS ble brukt til de statistiske analysene og resultatene presenteres som gjennomsnitt ±SD, der ikke annet er angitt.
Studien er godkjent av Statens legemiddelverk og Datatilsynet og er blitt vurdert av Regional komité for medisinsk forskningsetikk, Sør-Norge.
Resultater
Det var ingen relevante forskjeller i demografiske data mellom gruppene (ikke vist). Doser og blod-/plasmakonsentrasjoner av de ulike immundempende legemidlene er vist i tabell 1.
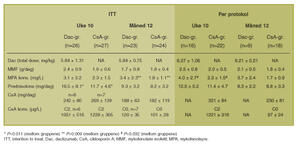
Tabell 1. Immundempende legemidler ogkorresponderende blod-/plasmakonsentrasjoner for ITT og per-protokoll populasjonene ved uke 10 og måned 12 i Dac- og CsA-gruppene.
Inklusjonen av pasienter ble stoppet av sikkerhetskomiteen etter randomisering av 54 pasienter (27 i hver gruppe) av de 70 planlagte pasientene på grunn av uakseptabelt høy akutt rejeksjonsfrekvens i Dac-gruppen (70,4%) sammenliknet med CsA-gruppen (29,6%) (p=0,006). Rejeksjonsfrie pasienter under studieperioden er vist i figur 1. Graftoverlevelsen var henholdsvis 26/27 (96,3%) og 25/27 (92,6%) i Dac- og CsA-gruppene og pasientoverlevelsen var 24/27 (88,9%) i begge gruppene ett år etter transplantasjon.
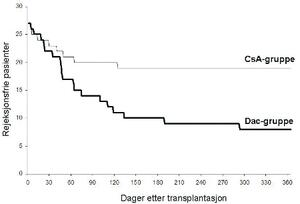
Figur 1. Antall rejeksjonsfrie pasienter under studien (fet linje Dac-gruppen; tynn linje CsA-gruppen).
Nyrefunksjonen var ikke signifikant forskjellig 10 uker etter transplantasjon mellom Dac- og CsA-gruppene (58 ±16 vs. 60 ±20 ml/min, p=0,61). Tolv måneder etter transplantasjonen var imidlertid nyrefunskjonen signifikant lavere i Dac-gruppen (52±20 vs. 69±29 ml/min, p=0.029) (figur 2). Beskrevet på en annen måte så minsket nyrefunksjonen med 7±18 ml/min i Dac-gruppen mens nyrefunksjonen forbedredes med 7±18 ml/min i CsA-gruppen gjennom det første året etter transplantasjon (p=0.012). Subanalyse av per-protokoll populasjonen ved uke 10 (Dac-gruppen, n=15; CsA-gruppen, n=22) og måned 12 (Dac-gruppen, n=9; CsA-gruppen, n=18) viste tilsvarende resultater. Den gjennomsnittlige forandringen i per-protokoll populasjonen fra uke 10 til måned 12 var henholdsvis -0,3±11 og 8±20 ml/min for de to gruppene (p=0.20).
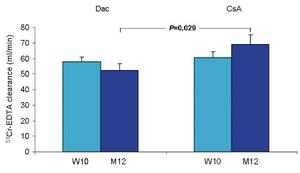
Figur 2. Gjennomsnittlig (+SEM) nyrefunksjon (51Cr-EDTA) for Dac-gruppen (uke 10, n=24; måned 12, n=22) og CsA-gruppen (uke 10, n=26; måned 12, n=23).
Verken blodtrykk, blodlipider eller glukosetoleransen var signifikant forskjellige mellom gruppene under studien, men alle parametrene tenderte til å være i favør av Dac-gruppen. Urinveisinfeksjoner forekom hos en signifikant lavere andel av Dac-pasientene (p=0,026), mens CsA-pasientene hadde færre lymfoceler (p=0,046). Andre bivirkninger var ikke statistisk forskjellig mellom de to gruppene.
Diskusjon
Strategien å bruke en CNI-fri immundempende behandling til nyretransplanterte pasienter med antatt lav immunogen risiko basert på DR-vevstyping viste seg å ikke være vellykket. Studien ble stoppet av sikkerhetskomiteen etter inklusjon av 54 av de planlagte 70 pasientene hadde blitt randomisert. Den akutte rejeksjonsraten hos de pasientene som ikke fikk CNI var over 70% sammenliknet med ca. 30% hos de som fikk standard immunosuppresiv behandling ved Rikshospitalet.
Nyrefunksjonen var også dårligere 12 måneder etter transplantasjon hos de som ikke fikk CNI. Dette funnet er ikke på linje med tidligere ikke-randomiserte studier som har vist en bedring i nyrefunksjon ved CNI-fri behandling (15-19). Sannsynligvis har alle akutte rejeksjonsepisoder som forekom i Dac-gruppen påvirket nyrefunksjonen negativt. Tilsvarende resultater fås imidlertid også om man analyserer kun de pasientene som har stått på per-protokoll behandling gjennom hele studien. Denne analysen er selvfølgelig begrenset av detlave antall som fullførte per-protokoll behandlingen gjennom hele studien (Dac-gruppen, n=9; CsA-gruppen, n=18).
Uansett om denne strategien er uegnet for disse pasientene med tanke på akutt rejeksjons frekvens, så var verken graft- eller pasientoverlevelse influert av dette i oppfølgingsperioden på ett år etter transplantasjon. Forskjellen i nyrefunksjon kan imidlertid påvirke langtidsresultatene negativt (20).
Alle kardiovaskulære risikoparametere (blodtrykk, blodlipider og glukosetoleranse) som ble undersøkt i studien tenderte til å være bedre hos Dac-pasientene. Imidlertid var det totale antallet pasienter som fullførte for lavt til å trekke noen sikre konklusjoner vedrørende dette.
Konklusjon: Strategien ved å bruke DR-vevstyping til å finne førstegangstransplanterte pasienter som kunne klare seg uten CNI-basert behandling var ingen suksess. Også denne gruppen pasienter trenger noe mer immundemping, i alle fall under den tidlige fasen etter transplantasjon.
Referanser
- Opelz G, Dohler B, Laux G. Long-term prospective study of steroid withdrawal in kidney and heart transplant recipients. Am J Transplant 2005; 5:720–728.
- Meier-Kriesche HU, Ojo AO, Port FK, Arndorfer JA, Cibrik DM, Kaplan B. Survival improvement among patients with end-stage renal disease: trends over time for transplant recipients and wait-listed patients. J Am Soc Nephrol 2001; 12:1293–1296.
- Marcen R, Pascual J, Teruel JL, Villafruela JJ, Rivera ME, Mampaso F, Burgos FJ, Ortuno J. Outcome of cadaveric renal transplant patients treated for 10 years with cyclosporine: is chronic allograft nephropathy the major cause of late graft loss? Transplantation 2001; 72:57–62.
- Meier-Kriesche HU, Schold JD, Kaplan B. Long-term renal allograft survival: have we made significant progress or is it time to rethink our analytic and therapeutic strategies? Am J Transplant 2004; 4:1289–1295.
- Foley RN, Parfrey PS, Sarnak MJ. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am J Kidney Dis 1998; 32:S112-119.
- Opelz G, Dohler B. Lymphomas after solid organ transplantation: a collaborative transplant study report. Am J Transplant 2004; 4:222–230.
- Koehl GE, Schlitt HJ, Geissler EK. Rapamycin and tumor growth: mechanisms behind its anticancer activity. Transplantation Reviews 2005; 19:20–31.
- Kauffman HM, Cherikh WS, Cheng Y, Hanto DW, Kahan BD. Maintenance Immunosuppression with Target-of-Rapamycin Inhibitors is Associated with a Reduced Incidence of De Novo Malignancies. Transplantation 2005; 80:883–889.
- Kaplan B, Srinivas TR, Meier-Kriesche HU. Factors associated with long-term renal allograft survival. Ther Drug Monit 2002; 24:36–39.
- Meier-Kriesche HU, Ojo A, Hanson J, Cibrik D, Lake K, Agodoa LY, Leichtman A, Kaplan B. Increased immunosuppressive vulnerability in elderly renal transplant recipients. Transplantation 2000; 69:885–889.
- Loucaidou M, McLean AG, Cairns TD, Griffith M, Hakim N, Palmer A, Papalois V, Van Tromp J, Loucaides C, Welsh KI, Taube D. Five-year results of kidney transplantation under tacrolimus-based regimes: the persisting significance of vascular rejection. Transplantation 2003; 76:1120–1123.
- Nett PC, Heisey DM, Shames BD, Fernandez LA, Pirsch JD, Sollinger HW. Influence of kidney function to the impact of acute rejection on long-term kidney transplant survival. Transpl Int 2005; 18:385–389.
- Fellström B, Jardine AG, Soveri I, Cole E, Neumayer HH, Maes B, Gimpelewicz C, Holdaas H. Renal dysfunction is a strong and independent risk factor for mortality and cardiovascular complications in renal transplantation. Am J Transplant 2005; 5:1986-1991.
- Åsberg A, Midtvedt K, Line PD,Narverud J, Holdaas H, Jenssen T, Reisaeter AV, Johnsen LF, Fauchald P, Hartmann A. Calcineurin inhibitor avoidance with daclizumab, mycophenolate mofetil, and prednisolone in DR-matched de novo kidney transplant recipients. Transplantation 2006; 82:62–68.
- Vincenti F, Ramos E, Brattstrom C, Cho S, Ekberg H, Grinyo J, Johnson R, Kuypers D, Stuart F, Khanna A, Navarro M, Nashan B. Multicenter trial exploring calcineurin inhibitors avoidance in renal transplantation. Transplantation 2001; 71:1282–1287.
- Dudley C, Pohanka E, Riad H, Dedochova J, Wijngaard P, Sutter C, Silva HT, Jr. Mycophenolate mofetil substitution for cyclosporine a in renal transplant recipients with chronic progressive allograft dysfunction: the «creeping creatinine» study. Transplantation 2005; 79:466-475.
- Abramowicz D, Manas D, Lao M, Vanrenterghem Y, Del Castillo D, Wijngaard P, Fung S. Cyclosporine withdrawal from a mycophenolate mofetil-containing immuno-suppressive regimen in stable kidney transplant recipients: a randomized, controlled study. Transplantation 2002; 74:1725–1734.
- Schnuelle P, van Der Heide JH, Tegzess A, Verburgh CA, Paul LC, van Der Woude FJ, de Fijter JW. Open Randomized Trial Comparing Early Withdrawal of either Cyclosporine or Mycophenolate Mofetil in Stable Renal Transplant Recipients Initially Treated with a Triple Drug Regimen. J Am Soc Nephrol 2002; 13:536–543.
- Smak Gregoor PJ, de Sevaux RG, Ligtenberg G, Hoitsma AJ, Hene RJ, Weimar W, Hilbrands LB, van Gelder T. Withdrawal of cyclosporine or prednisone six months after kidney transplantation in patients on triple drug therapy: a randomized, prospective, multicenter study. J Am Soc Nephrol 2002; 13:1365–1373.
- First MR. Renal function as a predictor of long-term graft survival in renal transplant patients. Nephrol Dial Transplant 2003; 18.
(Publisert i NFT nr. 3/2007 side 26–28.)
