Kan Legemiddelverkets rådgivningstjeneste hjelpe ditt innovative prosjekt?
Tekst: Sayeh Ahrabi, seksjonssjef / prosjektleder VIRIL,
Statens legemiddelverk
Sub-optimale forsøk som ikke gir pålitelige eller tolkbare resultater kan i verste fall forårsake at gode legemiddelkandidater velges bort. Veiledning ved Legemiddelverket kan bidra til at legemiddelstudier planlegges og utføres riktig fra første forsøk, slik at bedrifter og samfunnet sparer tid og ressurser.
Fokus på legemiddelinnovasjon
Det finnes fortsatt store og viktige sykdomsgrupper som mangler effektiv behandling. Myndighetene har et ansvar for å tilrettelegge for at ny og effektiv behandling når pasienter. For tiden er det et omfattende og positivt fokus på helse- og legemiddelinnovasjon i Norge og ellers i Europa. Økt forskningskvalitet og nasjonal næringsutvikling er begge viktige søyler i den nye helse- og omsorgsstrategien (HO21) (1).
Suksesskriteriet for et legemiddel, og dermed firmaet som utvikler legemiddelet, er oppnådd markedsføringstillatelse (MT). Det er en komplisert, kostbar, tidskrevende og risikofylt vei å gå.
EMA gir vitenskapelig rådgivning
I Norge er vi velsignet med sterke akademiske miljøer som aktivt bidrar til innovative ideer. Det har resultert i etablering av et førtitalls (tall fra 2013) små og mellomstore bedrifter (SMBer, eller SME på engelsk) som har som mål å utvikle nye legemidler.
Noe av det som kjennetegner et legemiddelfirma i oppstartsfasen er:
- Få ansatte, hvilket betyr at firmaet må kjøpe inn kompetanse og tjenester.
- Begrenset tid og penger. Firmaet må vise til positive resultater i tidlige utviklingsfaser for å hente inn mer kapital for videreutvikling av sitt produkt. Dette innebærer at firmaet oftest kun får én sjanse til å gjennomføre en studie.
- Regulatorisk kompetanse er ikke det første som prioriteres, til tross for at investorer er opptatt av regulatorisk status for produktet og at firmaet må gjennomføre komplisert dialog med myndighetene.
Den europeiske legemiddelmyndigheten (EMA) etablerte et SME-kontor i 2005 (2) for å imøtekomme de spesielle behovene små firmaer har og for å starte en dialog med dem så tidlig som mulig i utviklingsløpet. Dedikerte ansatte på dette kontoret er lett tilgjengelige for SMEer og gir råd og veiledning per telefon og e-post. I tillegg har EMA betydelig reduserte gebyrer for vitenskapelig råd til SMEer. Legemiddelverket anbefaler alle SMEer å søke SME-status hos EMA og benytte seg av dette tilbudet.
Vitenskapelig rådgivning er kun ett av tilbudene blant en rekke tjenester som EMA tilbyr under samlebegrepet «Pre-authorisation services» som har til hensikt å bidra til å fremme legemiddelinnovasjon (3).
Regulatorisk kompetanse på høyt europeisk nivå
Legemiddelgodkjenning i Europa skjer hovedsakelig gjennom samarbeid i det europeiske nettverket for legemiddelgodkjenning der Norge har de samme rettighetene og pliktene som de øvrige legemiddelmyndighetene. Nettverket består av eksperter fra nasjonale legemiddelmyndigheter. Statens legemiddelverk deltar aktivt i utredningsoppdrag og i regelverksutvikling i det europeiske samarbeidet samt at vi evaluerer søknader i alle faser av legemidlenes livssyklus. Dette gir en unik kompetanse i nasjonal sammenheng og danner grunnlaget for den brede regulatoriske kunnskapen om legemidler og legemiddelutvikling.
Nasjonal regulatorisk og vitenskapelig veiledningstjeneste
Flere europeiske myndigheter har fulgt EMAs modell og etablert nasjonale innovasjonskontorer for å gi støtte og råd til nasjonale aktører, blant dem rådgivningsmøter. De viktigste fordelene med nasjonale rådgivningsmøter er at de har kortere ventetid siden de er enklere og raskere å organisere, er mindre formelle, og kan gjerne fungere som en forberedelse til møte med EMA. I tillegg er det andre fordeler som nærhet/kortere reisevei og mulighet til å gjennomføre møtene på nasjonalspråket. Tilbud om nasjonalt rådgivningsmøte er spesielt nyttig for akademiske forskningsmiljøer (for eksempel ved sykehusene) som ikke får støtte fra EMA.
Regulatorisk/vitenskapelig veiledning kan med fordel også rettes mot tidligfase-forskning som vanligvis utføres i regi av akademiske miljøer, slik at det sikres høy regulatorisk kvalitet i prosjektene på et tidlig tidspunkt. Behovet for å øke verdien av biomedisinsk forskning er diskutert i Lancet, januar 2014 (4). Forfattere har påpekt viktigheten av at forskningen baserer seg på spørsmål som er av interesse for de som skal bruke resultatene. Derfor er det viktig å diskutere design av tidlige studier med regulatoriske eksperter som har kunnskap om hva som kreves for å produsere tolkbare resultater.
De nasjonale innovasjonskontorer fungerer som lavterskel førstelinjekontakt for å:
- gi rask veiledning,
- tilrettelegge kontakt med intern ekspertise ved mer kompliserte spørsmål,
- koordinere rådgivningsmøter ved forespørsel.
I Norden er det kun Läkemedelsverket i Sverige som har etablert et formelt Innovasjonskontor for å støtte innovasjonen innen life science (5). Hovedmålet er å øke kunnskapen om regelverk for legemidler hos målgrupper som innovatører, akademia og bedrifter innen life science. Oppgavene er videre definert slik:
- Arbeide for at vitenskapelig og regulatorisk rådgivning når flere målgrupper
- Være et enkelt og tydelig kontaktpunkt inn i Läkemedelsverket
- Aktivt å synliggjøre Läkemedelsverkets tjenester relatert til innovasjon
I tillegg til å være første kontaktpunkt for veiledning og råd, organiserer Innovasjonskontoret i Sverige informasjonsmøter rettet mot akademia i de store universitetsbyene. I 2014 besluttet Läkemedelsverket å etablere et eget Innovasjonskontor i Gøteborg, i tillegg til Uppsala, for å komme nærmere forskere der. Läkemedelsverket har også utarbeidet en enkel veileder for innovatører «SME Guide» på deres nettside.
Den finske legemiddelmyndigheten (FIMEA) informerer på sin nettside at det er mulig å søke vitenskapelig veiledning, mens en slik informasjon ikke finnes på nettsiden til Sundhetsstyrelsen i Danmark eller den islandske legemiddelmyndigheten.
Status og ambisjon i Norge
Legemiddelverket erfarer et økende behov for rådgivning av små norske firmaer og akademiske institusjoner med hensyn til oppbygging av nødvendig dokumentasjon. I 2014 publiserte Legemiddelverket rutiner for å søke om vitenskapelig råd (6). Alle veiledningstjenester i organisasjonen er samlet under samme fane på nettsiden.
Henvendelser om vitenskapelig og regulatorisk veiledning vil bli besvart innen en uke. Normalt vil det kunne gjennomføres møte med nødvendige eksperter fire til seks uker senere. Tjenesten er inntil videre gratis. Siden opprettelsen av tjenesten i 2013 er det gjennomført 46 møter. Disse omfatter trolig bare en brøkdel av aktørene som vil ha glede av vitenskapelige og regulatoriske råd. Legemiddelverket har utført en liten kartlegging av behov for veiledning i akademiske miljøer og norske SMEer. Responsene indikerer at erkjent behov for regulatorisk/vitenskapelig veiledning er omvendt proporsjonal med kvaliteten på søknader og dokumentasjon aktørene leverer. Dette er i samsvar med tilbakemeldinger fra det svenske Innovasjonskontoret. Uerfarne aktører innen legemiddelutvikling vet ikke hva de kan spørre om eller hvordan de kan bruke sin regulatoriske myndighet. Aktiviteter for å gjøre denne tjenesten bedre kjent i nasjonale miljøer bør derfor prioriteres.
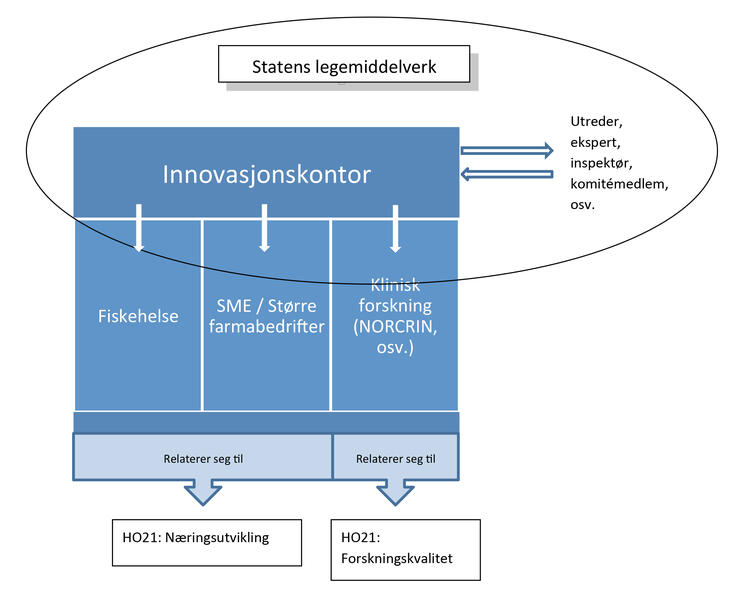
En strategisk anbefaling i HO21 er at Legemiddelverket får mandat og ressurser til å etablere innovasjonskontor for å veilede norske bedrifter som driver legemiddelutvikling. Dersom dette blir en realitet, er det naturlig å bygge på svenskenes erfaring og inngå tett samarbeid med andre nordiske legemiddelmyndigheter.
Ved å etablere Innovasjonskontor kan Legemiddelverket:
- tilby lavterskel og tilgjengelig veiledningstjeneste basert på vår unike regulatoriske kompetanse
- øke sannsynligheten for at nye effektive legemidler og nye legemiddelbehandlinger kommer pasienter til gode
- bidra til økt kvalitet i norsk legemiddelinnovasjon og klinisk forskning.
Referanser
- HelseOmsorg21, et kunnskapssystem for bedre folkehelse. 2014.
- ema.europa.eu/ Human regulatory/ SME office
- EMA annual report 2013
- Research: increasing value, reducing waste. The Lancet series, January 2014.
- läkemedelsverket.se / Företag/ Innovasjonskontoret
- legemiddelverket.no/Godkjenning og regelverk/ Veiledning/ Legemiddelutvikling eller Klinisk forskning
Artikkelen baserer seg på og er en videreutvikling av presentasjonen «Legemiddelverket er VIRILisert!» på Farmasidagene 2014.
(Publisert i NFT nr. 2/2015 side 8–9.)
