Stimuli-responsive polymerer i farmasøytisk forskning prinsipper, design og fremtidsaspekter
Tekst: Marianne Hiorth, førsteamanuensis, Avdeling for farmasi,
Farmasøytisk institutt, UiO
 Det vanligste ved tradisjonell levering av legemidler er at legemiddelet frisettes raskt og man får en hurtig stigning i serumkonsentrasjonen av legemiddelet. Stigningen vil ofte fort bli etterfulgt av en minking i serumkonsentrasjonen. En respons som kommer umiddelbart etter administrasjon er selvsagt ønskelig i mange tilfeller. Ofte vil det allikevel være en fordel at det oppnås en jevn konsentrasjon av legemiddelet i kroppen over en lengre tidsperiode. Design av legemiddelsystemer med kontrollert frisetting har derfor blitt utviklet. Kontrollert frisetting vil si at legemiddelet blir levert med en forhåndsbestemt hastighet over en forhåndsbestemt tidsperiode. Selv om det har blitt gjort fremskritt innen området kontrollert frisetting ville det være en fordel med mer avanserte systemer for å kunne behandle ulike sykdommer som krever mer enn en jevn forutbestemt frisetting.
Det vanligste ved tradisjonell levering av legemidler er at legemiddelet frisettes raskt og man får en hurtig stigning i serumkonsentrasjonen av legemiddelet. Stigningen vil ofte fort bli etterfulgt av en minking i serumkonsentrasjonen. En respons som kommer umiddelbart etter administrasjon er selvsagt ønskelig i mange tilfeller. Ofte vil det allikevel være en fordel at det oppnås en jevn konsentrasjon av legemiddelet i kroppen over en lengre tidsperiode. Design av legemiddelsystemer med kontrollert frisetting har derfor blitt utviklet. Kontrollert frisetting vil si at legemiddelet blir levert med en forhåndsbestemt hastighet over en forhåndsbestemt tidsperiode. Selv om det har blitt gjort fremskritt innen området kontrollert frisetting ville det være en fordel med mer avanserte systemer for å kunne behandle ulike sykdommer som krever mer enn en jevn forutbestemt frisetting.
Sykdommer som krever mer av formuleringen er for eksempel diabetes og rytmiske hjerteforstyrrelser. Ved behandling av denne typen sykdommer vil det være gunstig om legemiddelet kunne bli frisatt som en respons på den fysiologiske tilstanden i kroppen. Størrelsen på dette signalet, det vil si den fysiologiske tilstanden, måtte kunne måles, og som en respons på signalet ble den rette mengden legemiddel frisatt. Fordelen ved å levere på riktig sted i kroppen til riktig tid er at det blir en mer effektiv behandling med færre bivirkninger. I tillegg ville det være nyttig om man kunne designet et system som skrudde seg av og på avhengig av stimuli. Denne artikkelen skal omhandle stimuli responsive drug delivery-systemer og da systemer som er basert på stimuli-responsive polymerer.
Polymerer
Polymerer er store makromolekyler med en molekylvekt fra 10 000 og opp mot det uendelige (1). Polymerene kan være langkjedete eller forgrenede. Felles for dem alle er at de består av en rekke små enheter (monomerer) som danner lange kjeder når de settes sammen (figur 1). Dersom polymeren er bygget opp av to eller flere ulike byggesteiner som repeteres, kalles den for en kopolymer. Polymerer kan dannes fra levende organsimer som for eksempel proteiner, nukleinsyrer og polysakkarider. Gelatin er en velkjent polymer som er bygget opp av proteiner. Polymerer og makromolekyler, både med naturlig og kjemisk opprinnelse anvendes innenfor et bredt spekter i farmasøytisk sammenheng. De representerer et stort utvalg med hensyn til fysikalsk-kjemiske egenskaper. Egenskapene er avhengig av blant annet molekylets størrelse. Polymerer som brukes som hjelpestoffer har som regel en molekylvektsfordeling og ikke en definert molekylvekt. Molekylvekten oppgis ofte med en gjennomsnittverdi.
Figur 1. En polymer er bygget opp av mange ulike byggesteiner (monomerer) og danner til sammen en lang kjede som kan kveile og folde seg og dermed innta ulike konformasjoner i rommet.
Polymerers egenskaper
Dannelse av gel
Dersom en vannløselig polymer blandes med vann, vil vi kunne få dannet en gel (figur 2) (2). Polymeren solvatiseres i vannet og begynner å svelle. Når en polymer sveller betyr det at polymerkjedene kveiler seg ut og inntar en mer langstrakt form. Når kjedene har kveilet seg ut kan kjedene danne bindinger med andre kjeder og dersom polymerkonsentrasjonen er høy nok, vil vi kunne få dannet en gel. For at viskal ha en ekte gel må det være konnektivitet i nettverket. Konnektivitet betyr at kjedene er bundet sammen slik at det er mulig å «gå» tørrskodd fra den ene siden av gelen til den andre siden av gelen. Om vi får dannet en gel er avhengig av mange ting, blant annet konsentrasjon, temperatur og tilstedeværelse av andre stoffer. Maskestørrelsen til nettverket sier noe om hvor store hull det er i nettverket og også hvor homogent nettverket er bygget opp (figur 2).
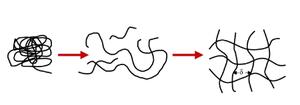
Figur 2. En polymer som legges i et godt løsemiddel vil solvatiseres og kjedene starter å kveile seg ut. Jo mer langstrakt kjedene blir, jo lettere er det å danne bindinger med andre kjeder. Dersom alle betingelser oppfylles, kan polymeren danne et kontinuerlig nettverk og vi har fått fremstilt en gel. d viser maskestørrelsen til nettverket.
Faseseparasjon
I gode løsemidler vil polymeren kveile seg ut og danne viskøse løsninger. I dårlige løsemidler vil kjedene krølle seg sammen (2). I et dårlig løsemiddel vil polymerkjedene heller reagere / være i kontakt med seg selv enn med løsemiddelet. I et dårlig løsemiddel er det de attraktive kreftene innad i polymeren som dominerer. Dersom løsemiddelet er dårlig nok, vil polymeren kunne felle ut og vi får en faseseparasjon. Et faseseparert system består av to ulike komponenter, løsemiddelet og polymeren. I et godt løsemiddel er det de repulsive kreftene som dominerer, det vil si at kjedene kveiler seg ut fordi de heller vil være i kontakt med vannet enn med seg selv. Det er lett å tenke seg at det vil skje dersom polymeren enten har positiv eller negativ ladning. I et godt løsemiddel tenker man seg at systemet består av kun én fase som er homogen ned til molekylnivå.
Stimuli-responsive polymerer – definisjon
Stimuli-responsive polymerer er definert som polymerer som kan gjennomgå store og plutselige endringer som respons på en forandring av miljøet rundt polymeren (3). Polymeren bør ha en ikke-linjær respons som følge av et eksternt påført stimuli. Andre navn for stimuli-responsive polymerer er stimuli-sensitive, intelligente, smarte eller miljø-sensitive polymerer.
Klassifisering
Det er mange måter å klassifisere stimuli-responderende systemer på. Det kan for eksempel klassifiseres ut fra hva slags type stimuli som gir respons (3, 4). Dette gir de to gruppene fysikalske stimuli og kjemiske stimuli. Nylig har man også begynt å klassifisere etter biokjemiske stimuli. Denne gruppen kan også ses på som en undergruppe av kjemiske stimuli. Når det gjelder de fysikalske stimuliene er det temperatur som er mest undersøkt. Andre fysikalske stimuli er lys, elektriske felt, magnetiske felt og trykk. Når det gjelder kjemiske stimuli er det pH som er mest undersøkt. Andre kjemiske stimuli er for eksempel endring i saltkonsentrasjon og ulike ioner. Biokjemiske stimuli kan være antigener eller enzymer.
Andre måter å klassifisere slike systemer på er etter systemets fysiske form. Det kan være kryssbundne hydrogeler, reversible hydrogeler, miceller, modifiserte overflater og konjugerte løsninger En tredje måte å klassifisere stimuli-responsive systemer på er om responsen skyldes en indre eller ytre påvirkning. En indre påvirkning skyldes en stimulus som kroppen selv produserer. Det kanvære temperaturendring eller pH-endring. En ytre påvirkning skyldes en stimulus som er tilført kroppen utenfra for eksempel elektriske signaler eller magnetisme.
Responser på formuleringen/polymeren
Det viktigste ved et stimuli-sensitivt system er at polymeren responderer dersom den utsettes for én bestemt stimulus. Stimulusen som polymeren utsettes for bør lede til dramatiske endringer (3). Disse endringene kan for eksempel gjøre noe med formen til polymeren/polymernettverket. Polymernettverket kan starte å svelle og vil da innta en åpnere struktur som kan tillate frisetting av legemidler, eller nettverket kan desvelle, det vil si innta en tettere struktur. Flere ulike stimuli kan trigge denne endringen hos polymeren. En påført stimulus kan også endre løseligheten til polymeren. Løseligheten til polymeren kan endres dersom den har en kritisk temperatur eller en kritisk pH som gjør at polymeren feller ut. En annen respons som ofte ses på et polymersystem er at det dannes et intrikat molekylært micelle-system. Polymerene endrer sin form ved å gå fra en utstrakt konformasjon til miceller og disse micellene kan starte å aggregere og danne en gel for eksempel ved en økning i temperaturen (figur 3) (5). En svært enkel respons på polymeren er at den går fra løsning til gel eller motsatt gel går til løsning (sol/gel-transisjon eller motsatt). Et eksempel på dette er at polymeren som er i løsning ved romtemperatur geler på stedet (in-situ) når den blir injisert i kroppen på grunn av temperaturendringen (6).

Figur 3. Flere polymerkjeder kan gå sammen og danne miceller dersom konsentrasjonen er høy nok. Hvis det lages mange nok miceller, kan disse gå sammen og det oppstår et kontinuerlig nettverk, en gel (5).
Ulike formuleringer på markedet
Det finnes flere ulike formuleringer på markedet som baserer seg på at en polymer reagerer på en bestemt stimulus og dermed frisetter legemiddelet. Det er viktig å påpeke at disse systemene kun responderer på en gitt stimulus og at det til dags dato ikke finnes noe legemiddel som frisettes fra en formulering som en respons på en spesiell sykdomstilstand.
Det kanskje mest kjente systemet som finnes på markedet som er er stimuli sensitivt er entero-drasjeringer. Responsen på polymeren skyldes endring i pH-verdien. Dette er et svært enkelt konsept som benyttes for å beskytte formuleringen mot det tøffe miljøet i magesekken. Bakgrunnen for entero-drasjeringer er at den gastrointestinale pHen øker fra magen til tynntarmen (7). I magen ligger pH mellom 1–2 mens den i tynntarmen ligger rundt 6–7. En pH-sensitiv polymer som løser seg ved pH 5–6 vil ligge som et beskyttende lag mens formuleringen er i magen og starte å løse seg når den kommer til tynntarmen.
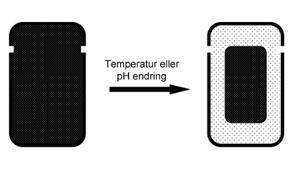
Figur 4. SQZGel-konseptet. Den kationiske polymeren sveller når den kommer i magesekken og hullene i kapselen plugges igjen. Når kapselen kommer over i tynntarmen desveller gelen og virkestoffet kan passere ut gjennom hullene (8).
Et eksempel på en formulering som leverer legemiddelet som en respons på temperatur og/eller pH er SQZGel® (figur 4) (8). Dette er et relativt enkeltsystem som kun kan gi kontrollert frisetting og ikke frisetting som respons på en sykdom. Formuleringen finnes på det utenlandske markedet og er en formulering der det aktive virkestoffet er diltiazem. Legemiddelet kan doseres kun en gang om dagen hvilket er en stor fordel for pasienten. Konseptet i dette stimuli-responsive systemet er at en temperatur responsiv polymer har noe som kalles en Lower Critical Solution Temperature, LCST (eller en Upper Critical Solution Temperature, UCST) og at en pH-sensitiv polymer har en kritisk pH-verdi. Figur 5 viser et fasediagram. Dersom polymersystemet har en temperatur som er under LCST har vi kun en fase, det vil si at interaksjonene mellom polymer og løsemiddel favoriseres. Økes imidlertid temperaturen over LCST vil polymeren felle ut og det oppstår en faseseparasjon. Kjedene krøller seg sammen fordi interaksjonen innad i polymeren er mer favoriserbar enn polymerens interaksjon med løsemiddelet og dets indre vil bestå av en mer hydrofob del, mens det ytre laget vil bestå av den mer hydrofile delen. LCST kan manipuleres ved å endre den hydrofile eller den hydrofobe balansen i polymeren. Dersom polymeren gjøres mer hydrofil vil LCST øke. Det motsatte skjer dersom polymeren gjøres mer hydrofob, da får man en minking av LCST. En liknende effekt ses for en polymer som er pH-responsiv. Dersom pH endres og blir høyere enn den kritiske pH-verdien vil vi få en sammenkrølling av polymerkjedene. Responsen pH kan ha på en polymer skyldes tilstedeværelse av enten sure grupper eller basiske grupper. Dersom pH endres vil en endring i ladningen til polymeren føre til en endring i det hydrodynamiske volumet til polymeren. Man får da en transisjon fra en kollapset tilstand til en utstrakt tilstand. Dette skyldes at polymeren går fra en uladet tilstand til en ladet tilstand.
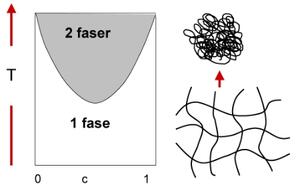
Figur 5. Dersom temperaturen er under LCST (Lower Critical Solution Temperature) er det kun én fase. Hvis temperaturen økes over LCST, vil polymeren starte å faseseparere og det oppstår to faser i systemet.
I SQZGel-konseptet er det slik at en hydrogel med en temperatur sensitiv polymer eller en pH-sensitiv polymer sammen med et legemiddel legges inn i en rigid kapsel med to hull. Når kapselen ankommer magen vil den pH-sensitive polymeren svelle og danne en gel. Som en respons på dette plugges hullene i kapselen igjen, slik at legemiddelet ikke blir frisatt. Når kapselen kommer over i tynntarmen blir gelen utsettatt for en ny stimulus, da pH endres og gelen desveller/krymper og legemiddelet skvises ut av hullene på kapselen. Dette kan designes til å skje med en kontrollert hastighet.
Fremtidsvisjoner
Glukose sensitive systemer
Et område der det er et stort ønske om forbedring når det gjelder administrasjon er innen behandling av diabetes type 1. I dag gis insulin som injeksjoner. En optimal formulering som skal levere insulin vil kun frisette insulin som en respons på at blodglukosenivået økes over en viss verdi. Mange ulike studier har blitt utført for å prøve å finne det perfekte system som er glukose-sensitivt.
Sol/gel-transisjon
I dette systemet er nettverket bygget opp av en polymer som har glukose bundet til seg (9,10). ConA (ConcanvalinA) er også til stede og denne kan bindes til glukose på fire forskjellige steder. Systemet opprettholdes som en gel ved at ConA bindes til glukosen som sitter på sidekjeden til polymeren (figur 6). Når glukose kommer i nærheten av formuleringen vil de frie glukosemolekylene kunne bytte plass med glukosemolekylene som sitter fast på kjeden, og dermed går nettverket fra å være en gel til å bli en løsning. Det vil hele tiden være en likevekt mellom bundet og fritt glukose og dersom blodglukosenivået går ned, vil ConA igjen kunne bindes til glukosemolekylene i polymeren og nettverket gjendannes. Ulike studier har vist at dette er et potensielt on-off-system når det gjelder frisetting av insulin fra formuleringen. En utfordring er imidlertid at man må forhindre at ConA forsvinner fra responsstedet når gelen blir en løsning. Et annet problem er at responsen til hydrogelen er for sakte. Responstiden bør ikke være lenger enn fem minutter.
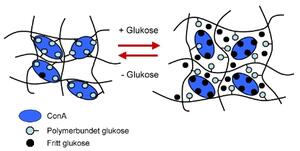
Figur 6. Løsning-går-til-gel fasetransisjon av en glukosesensitiv hydrogel. Store sirkler representerer ConA, et glukosebindende protein. Små åpne og lukkede åttekanter representerer polymer bundet glukose og fritt glukose. Insulin frisettes når fritt glukose binder seg til ConA (15).
Svelling av en glukose sensitiv hydrogel
Dette systemet er et reversibelt svellende nettverk som responderer på glukose konsentrasjonen i miljøet rundt gelen (11). Polymernettverket består av DEAEM (Dietylaminoetyl-g-etylenglykol). Immobilisert i gelnettverket finnes glukoseoksidase (GOD). Endringer på maskestørrelsen til gelnettverket modulerer frisettingen av insulin (figur 7). Konseptet i denne gelen baserer seg på at når GOD reagerer med glukose, synker pH lokalt i gelen. Dette fører til at gelen sveller som en følge av ionisering av den tertiære aminogruppen som skjer ved pH 7. Under denne pHen viser polymeren sterke svellende egenskaper. Over denne pHen er polymeren tilnærmet kollapset med mye lavere svellende ratio. Svelling av hydrogelen antas å forårsakes av glukose og dens konsentrasjon. Reaksjonen med glukose og dannelsen av glukonsyre antas å være det hastighetsbestemmende trinnet og ikke selve svellingen av gelen.
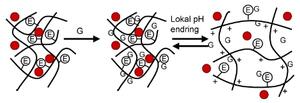
Figur 7. Gelen sveller når fritt glukose (G) binder seg enzymet i nettverket. Den enzymatiske reaksjonen (E) produserer en lokal pH-endring som fører til at polymeren får en positiv ladning og kjedene frastøter hverandre. Insulin frisettes når gelen sveller (4).
Behandling av sår
Stimuli-responsive systemer har også et stort potensial innen for eksempel behandling av sår. Det ville kunne være en stor fordel om antibiotika kunne leveres kun i de tilfellene det var nødvendig, for dermed å minke sannsynligheten for antibiotikaresistens. Antibiotikumet burde kun bli levert og trigget som en respons på at det er en bakteriell infeksjon i et sår. Ofte ved tildekking av skadet hud ser man at det oppstår infeksjoner. Mange sårhelende «plastere» inneholder antibiotika. Problemet knyttet til dette er at selv om det ikke oppstår en infeksjon har pasienten blitt utsatt for antibiotikumet. Som en løsning på dette problemet har det blitt forsøkt formulert en hydrogel som består av succinylert polyvinylalkohol (PVA) (12). Gentamycin er knyttet til PVA ved hjelp av en peptidlinker. Tanken bak designet er at dersom stoffer med trombinliknende aktivitet er til stede vil peptidlinkerenbli brutt ned og antibiotika frisettes. Studien viste at proteinaser utskilt fra Pseudomonas aeruginosa startet å kløyve peptidbindinger og gentamycin ble frisatt. Eksudatet fra de ikke infiserte sårene viste ingen hydrolytisk aktivitet.
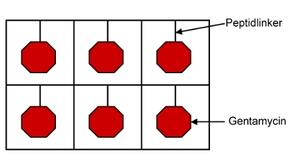
Figur 8. Skjematisk illustrasjon av et system som leverer antibiotika. Gentamycinet frisettes dersom peptidlinkeren brytes ned. Peptidlinkeren er sensitiv for trombinliknende stoffer som finnes i infiserte sår (12).
Andre områder stimuli-sensitive polymerer kan benyttes
Stimuli-responsive polymerer har ikke bare et stort potensial innen levering av legemidler, men har også et minst like stort potensial innen området gene delivery (13) og ikke minst innen området tissue engineering (14). I tissue engineering prøver man å lage løsninger bestående av polymerkomponenter som vil danne gel når de injiseres i kroppen. Disse løsningene kan for eksempel tilsettes veksthormoner og vil på innsprøytingsstedet fungere som et slags skjelett der nye celler kan vokse og utvikle seg. Dette vil være bedre grobunn enn det tomrommet som har oppstått som følge av at vev er operert vekk. Polymeren bør da i tillegg være biodegraderbar slik at den sakte, men sikkert forsvinner mens det nye vevet bygger seg opp. Et annet spennende område er artifisielle muskler som eventuelt vil kunne bestå av hydrogeler som bøyer seg når de utsettes for en elektrisk respons.
Foreløpig begrensninger
Når det gjelder fremtidsutsiktene for bruk av stimuli-responsive polymerer i drug delivery er det ingen tvil om at det har et stort potensial. Men foreløpig er det en del begrensninger ved disse systemene (3). For de fleste formuleringene er responstiden til polymeren for lang. Det tar gjerne 30 minutter før en ser den fulle effekten forårsaket av én spesiell stimulus. Det er ønskelig med en respons i løpet av et par minutter. Et annet begrensende problem er at en del av de stoffene som er sensitive for ulike stimuli ikke er godkjent av FDA. Det vil si at de kan være toksiske, og om ikke polymeren er toksisk, kan for eksempel kryssbinderen være toksisk eller noen av stoffene brukt under produksjon av formuleringen være toksisk (for eksempel initiatorer ved polymerisasjonsprosesser). Biodegraderbarhet er ikke alltid nødvendig, men i mange tilfeller kan det være en fordel at nettverket degraderes i kroppen over tid.
Konklusjon
Potensialet for å bruke stimuli-responsive polymerer for levering av legemidler og også til andre applikasjonsområder er stort. De formuleringene som finnes på markedet baserer seg på frisetting som følge av et påført stimuli, men de responderer ikke på en stimulus som skyldes selve sykdomstilstanden. Mest ønskelig er det å formulere et system som kan utnytte de stimuli kroppen sender ut i forbindelse med en sykdom. Legemiddelet vil da bli levert på riktig sted til riktig tid, det vil si når det er behov for det aktuelle legemiddelet.
De stimuli-sensitive polymersystemene det har blitt forsket mest på er temperatur og pH-responsive polymerer formulert som hydrogeler. Fordelen med disse stimuliene er at disse variablene finnes i kroppen og ikke trenger å påføres utenfra som man må med for eksempel elektrostimulering eller lysaktivering. Responsen som følge av en påført stimulus skyldes dramatiske endringer ipolymerens form, løselighet, dannelsen av miceller eller sol/gel-transisjon. Optimalisering av systemene er nødvendig da responstiden er for lang, ofte opp mot 30 minutter. Biokompatibiliteten til de utforskede systemene har også vært et problem. Videre forsking og muligens utvikling av nye polymerer og kryssbindere kan være nødvendig for å kunne fullt ut utnytte det store potensialet som ligger i et stimuli-sensitivt drug delivery-system.
Referanser
- Elias, H.G. An introduction to Polymer Science. 1997. VCH. New York, USA.
- Grosberg, A.Y., Khoklov, A.R., Giant Molecules. Here there and everywhere. 1997 Academic Press. San Diego, USA.
- Gil, E. S. et al. Stimuli-reponsive polymers and their bioconjugates. 2004. Progress in Polymer Science. 29(12).
- Qiu, Y. et al. Environment-sensitive hydrogels for drug delivery. 2001. Advanced Drug Delivery Reviews. 53(3).
- Lau, B.K., Wang, Q, Sun, W., Li.L., Micellization to gelation of a triblock copolymer in water: Thermoreversibility and scaling, (2004), Journal of Polymer Science Part B: Polymer Physics 42(10).
- Hatefi,A., Amsden,B., Biodegradable injectable in situ forming drug delivery systems. 2002. Journal of Controlled Release. 80.
- Friend, D.R., Oral Colon Specific Drug Delivery. 1992. CRCPress. Florida, USA.
- Gutowska, A., et al. Squeezing hydrogels for controlled oral drug delivery. 1997. Journal of Controlled Release. 48(2-3)
- Obaidat, A. A., Park, K., Characterization of protein release through glucose-sensitive hydrogel membranes. 1997. Biomaterials. 18(11)
- Obaidat, A. A., Park, K, Characterization of glucose dependant gel-sol phase transition of the polymeric glucose concanvalinA hydrogel system. 1996. Pharm.Res 13.
- Podual, K., DoyleIII, F. J., Peppas, N. A. Glucose-sensitivity of glucose oxidase-containing cationic copolymer hydrogels having poly(ethylene glycol) grafts. 2000. Journal of Controlled Release 67(1).
- Suzuki, Y. et al. A new drug delivery system with controlled release of antibiotic only in the presence of infection. 1998. Journal of Biomedical Materials Research. 42(1).
- Piskin, E.; Dincer, S.; Tuerk, M. Gene delivery: Intelligent but just at the beginning. 2004. Journal of Biomaterials Science, Polymer Edition 15(9).
- Lee,K., Y, Mooney, D. Hydrogels for tissue engineering. 2001. Chemical Reviews 101 (7).
- Hilt, J. Z., Byrne, M., E. Configurational biomimesis in drug delivery: molecular imprinting of biologically significant molecules. 2004. Advanced Drug Delivery Reviews. 56(11).
(Publisert i NFT nr. 6/2007 side 28–32.)
