Klinisk legemiddelforskning i Nyco
– et 40 års tilbakeblikk. I oktober 2007 markerte 85 av tidligere og dagens medarbeidere fra den kliniske forskningsenheten i Oslo til Nyegaard & Co (Nyco)/GE Healthcare at det var 40 år siden den første norske spesialenheten for legemiddelutprøvninger i industrien ble opprettet.

Tekst: Erik Andrew, Giftinformasjonen, Sosial- og helsedirektoratet og Avdeling for farmasøytisk biovitenskap, Farmasøytisk institutt, Universitetet i Oslo, og Kari Sveen, Medinnova AS, Rikshospitalet, Oslo
Det særegne med Klinisk FoU var ikke at den ble den største norske kliniske utprøvningsorganisasjonen, men at den i en lang periode var ansvarlig for globale strategier og gjennomførte utprøvningsprogrammer i mange verdensdeler for minst 12 nye originalpreparater hvorav åtte kom fra egne patenter i Oslo. Forskningen og den kliniske utprøvningen med disse legemidlene, og særlig for kontrastmidlene, førte til over 60 doktorgrader i Norden og bidro til et unikt klinisk forskningsmiljø i Norge og også internasjonalt på sitt felt.
BAKGRUNN
Om Nyco
På 1960-tallet hadde den farmasøytiske industribedriften Nyegaard & Co (Nyco) under 200 ansatte og omsetningen i 1966 var 26 mill. kr (1). Klinisk forskning hadde en lang tradisjon i Nyco basert på aktiv forskning fra 1930-årene innen leverekstrakter, allergenekstrakter og ACTH-produkter. Sent på 50-tallet ble to nye produkter, røntgenkontrastmiddelet Isopaque® (metrizoat) og reagensmiddelet til kontroll av antikoagulasjonsbehandling Thrombotest®, lansert og de trengte klinisk testing i Vest-Europa (2). I norsk sammenheng hadde Nyco et sterkt vitenskapelig fundament og viste tidlig vilje og evne til å dokumentere sine produkter. Fra å ha vært en norsk legemiddelbedrift rettet Nyco i 1960-årene sin markedsføring også mot Norden og Europa.
Om kliniske legemiddelutprøvninger i Norge
Sett med dagens øyne var kravene på 1960-tallet til klinisk utprøvning og vitenskapelig dokumentasjon beskjedne for å få markedsført nye legemidler. Statens legemiddelkontroll ble først formelt etablert i 1974 (3) og på 60-tallet forelå det ingen krav til etisk eller faglig forhåndsgodkjenning av kliniske utprøvninger. Anført av professor Erik Enger – som nettopp hadde skrevet sin bok om kontrollerte medikamentforsøk (4) – begynte norske leger og myndigheter å interessere seg for metoder og prinsipper for utprøvning av nye legemidler. I kjølvannet av thalidomidkatastrofen ble kravene til dyreforsøk og etter hvert også til kliniske forsøk betydelig skjerpet.
Etablering av Klinisk avdeling, Nyco
Direktøren, cand.pharm. Olav Bjørnson, var drivkraften i opprettelsen av en egen avdeling i Nyco for klinisk utprøvning og dokumentasjon. Cand.pharm. Kamilla Dahlstrøm fikk i 1967 oppgaven med å bygge opp Klinisk avdeling. Dahlstrøm hadde en solid og allsidig erfaring innen klinisk forskning og informasjon fra Vitenskapelig avdeling i Nyco fra 1958. I startfasen besto avdelingen av to-tre fagpersoner og en sekretær. I tillegg til kliniske utprøvninger med Nycos egne legemidler, gjennomførte avdelingen utprøvninger med lisensprodukter for eksempel fra Glaxo, som den gang ikke hadde eget datterselskap i Norge. Klinisk avdeling hadde ansvar for videre kliniske studier med Isopaque® og uttesting av nye reagenser, men det var først etter at det ikke-joniske kontrastmiddelet Amipaque® (metrizamid) kom i klinisk prøvning tidlig på 70-tallet at de internasjonale utprøvningene og samarbeidet med tyske Schering AG og amerikanske Sterling-Winthrop skjøt fart. Etter hvert ble det også et nært klinisk samarbeid med Daiichi i Japan. Anført av Kamilla Dahlstrøm etablerte avdelingen i disse årene et imponerende internasjonalt kontaktnett med ledende radiologiske miljøer.
UTVIKLING KLINISK AVDELING / KLINISK FOU
Arbeidsområdene i Klinisk FoU i disse 40 årene reflekterer de forskjellige strategier og organisasjonsmodeller som firmaet har gjennomgått. Men kompetansen på klinisk utprøvning, klinisk dokumentasjon og publisering har alle disse årene ligget i bunnen. Fra å være en generell og bred klinisk/medisinsk avdeling på mange legemiddelområder frem til ca. 1980, har avdelingen utviklet seg til å bli en høyspesialisert internasjonal enhet for klinisk legemiddelforskning innen imaging (kontrastmidler innen røntgen, MR og ultralyd og radiofarmasøytiske midler). I tråd med utviklingen av firmaet og den kliniske enheten har også avdelingen flyttet mye rundt i forskjellige bygninger på Storo i Oslo (tabell 1).

Endrede krav til faglige standarder og klinisk dokumentasjon har medført at den kliniske enheten stadig har gjennomgått struktur- og organisasjonsendringer. Mens de kliniske medarbeiderne i 60- og 70-årene var involvert i alle ledd i den kliniske dokumentasjonsprosessen fra bakgrunnsdokumentasjon for kliniske prøvninger, planlegging av utprøvningsprogrammer og enkeltutprøvninger, monitorering, databehandling, statistikk, kvalitetssikring, rapport- og publikasjonsskrivning, ble etter hvert de fleste arbeidsoppgavene spesialiserte og påvirket organisasjonsstrukturen. Fra 1980-tallet ble behovet for spesialkompetanse på de enkelte leddene i prosessen mer uttalt og førte til at langt flere yrkesgrupper ble ansatt (databehandlere, statistikere, monitorer, kvalitetsmedarbeidere etc.).
De første 15 til 20 årene var samarbeidet mellom Klinisk FoU og sykehus/klinikere intimt og preget av felles interesse for faglig utvikling og forskning. Det var lite penger involvert i prosessen. Sett med dagens krav til habilitet, etikk og regulering synes kanskje forholdene naive, men systemene var effektive og begge parter var tilfredse. De siste 25 år har kostnadsutviklingen og reguleringen av kliniske prøvninger i takt med samfunnsutviklingen for øvrig endret betydelig på hele utprøvningsprosessen. Dette reflekterer også struktur og organisasjon av Klinisk FoU i dag. En annen stor forskjell fra de første 20 årene er større krav til fremdrift av kliniske prøvninger og sterkere markedsorientering.
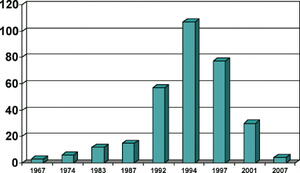
Figur 1. Antall ansatte som rapporterte til klinisk avdeling / FoU i Nyco / GE Healthcare, Oslo.
Det høyeste tallet på antall medarbeidere som var en del av Klinisk FoU i Oslo, var 107 i 1994 (figur 1). Ca. 25 av disse medarbeiderne befant seg dette året i 13 forskjellige land i Europa. Antall medarbeidere som faglig og personalmessig rapporterte til Klinisk FoU i Oslo varierte over tid pga. ulik produkttilgang og prosjektorganisering og at kliniske medarbeidere i datterselskapene rapporterte lokalt i perioder. I 1988 opprettet Klinisk FoU en egen avdeling – Klinisk farmakologisk laboratorium (Fase-1 enhet) – ved Det Norske Radiumhospital i Oslo. I 1993 ble det etablert en egen klinisk utprøvningsenhet med 10 medarbeidere i tilknytning til firmaets datterselskap i München, Tyskland. Etter fusjonen med det engelske firmaet Amersham i 1996 ble selskapet Nycomed-Amersham flyttet til England og fra 1999 fulgte hovedkvarteret for Klinisk FoU med på lasset. Mens forskningssjefene for Klinisk FoU i Oslo var globalt ansvarlig for den kliniske dokumentasjonen til firmaet fram til 1999, ble nå Klinisk område i Oslo en underenhet av den kliniske organisasjonen i England (tabell 2). Antall medarbeidere i den kliniske satellitten i München ble trappet opp og ble en selvstendig enhet. Fraår 2000 ble en rekke stillinger i Klinisk FoU i Oslo overført til den kliniske enheten i USA (Princeton) og nedtrappingen av Oslo-enheten var i full gang. I 2004 ble Amersham Health (som moderfirmaet nå het) kjøpt opp av det amerikanske storkonsernet General Electric og legemiddelenheten fikk navnet GE Healthcare. I 2007 ble den kliniske enheten i Oslo redusert til fire personer (figur 1). En del tidligere medarbeidere fra Klinisk FoU har imidlertid andre stillinger i selskapet.

De første 15 årene foretok avdelingen kliniske prøvninger på flere produktområder innen farmakoterapi og diagnostikk. En videreutvikling av Nycos forskningsprodukter innen salicylater fant sted (Novid®, Globentyl®). Allergenekstrakter var et betydelig forskningsområde på 70-tallet og Spectralgenserien med en rekke forskjellige allergenekstrakter til diagnose og behandling ble introdusert sammen med Pharmacia AB.
Klinisk FoU bidro også med klinisk dokumentasjon på en rekke Glaxo-produkter (Becotide®, Ventolin®, Trandate®, Zantac®, flere cefalosporiner) inntil samarbeidet opphørte i 1981.
Kliniske prøvninger med det innlisensierte psoriasismiddelet Methoxsalen® på slutten av 70-tallet skal også nevnes. Før arbeidet med klinisk uttesting av laboratoriediagnostika ble overført til en egen Reagensavdeling på 70-tallet, arbeidet kliniske medarbeidere med Nycos egenutviklede Thrombotest®, Normotest®, Cephotest® og Seronorm®.

Figur 2. Utviklingstider (år) inkludert kliniske prøvninger av noen sentrale kontrastmidler.
Helt fra 1967 arbeidet avdelingen med kliniske prøvninger med en rekke formuleringer av Isopaque®. Tidlig og midt på 70-tallet startet arbeidet med å klinisk dokumentere verdens første ikke-joniske kontrastmiddel Amipaque®, først ved myelografi, senere ved angiografi. Amipaque® var basert på en idé fra den svenske radiologen Torsten Almén og var banebrytende innen røntgenkontrastmidler. Utprøvningserfaringene med Amipaque® skapte grunnlaget for alle de globale kliniske utprøvningsprogrammene i regi av Klinisk FoU med Omnipaque® (iohexol) og en rekke andre kontrastmidler innen røntgen, MR og ultralyd. Fra slutten av 90-tallet var også Oslo-avdelingen sterkt involvert i kliniske utprøvninger med radiofarmasøytiske diagnostika (nukleærmedisinske preparater). De viktigste legemidlene som Klinisk område i Oslo har utarbeidet klinisk dokumentasjon på er nevnt i tabell 3. Åtte av produktene er patentert basert på egenforskning i Oslo. For de andre produktene (kjøpte patenter, samarbeidsavtaler) har Klinisk FoU i praksis koordinert den globale kliniske utprøvningen. For tre nye produkter (CT partikler, sprodiamid og Clariscan®) har den kliniske utprøvningen blitt stanset da det ikke var liv laga for disse produktene. I figur 2 er illustrert tidsforløpet for fase 1–3 dokumentasjonen som førte frem til første registrering/markedsføringstillatelse for noen sentrale legemidler. En rekke møter før start, underveis og etter avslutning av utprøvningsprogrammene har i disse årene blitt holdt i Europa og USA.

For å få strukturert og samlet mye av den vitenskapelige dokumentasjonen som ble skaffet til veie av de internasjonale utprøvningene var Klinisk FoU sterkt involvert i utarbeidelsen av en rekke tidsskriftssupplementer knyttet til enkeltprodukter (tabell 4), ofte basert på internasjonale symposier.

BETYDNING FOR NORSK LEGEMIDDELFORSKNING,
MEDISIN OG FARMASI
Det kan være vanskelig å skille bidraget fra Klinisk FoU fra bidraget fra firmaet som helhet. Som den eneste tunge industriaktøren innenfor original legemiddelforskning og klinisk dokumentasjon i Norge var kontakten med norsk medisin, farmasi og forskning god, spesielt de første 20 årene hvor firmaet var involvert i en rekke produktområder. Etter at firmaet ble et spesialisert imaging-foretak fra 80-årene har den brede kontaktflaten i Norge avtatt, og etter hvert skjedde dette også innen radiologi og nukleærmedisin da Norge ble et mindre viktig land for et internasjonalt selskap med hovedsete i England.
Spesielt på 70-, 80- og delvis 90-tallet førte den intense forskningen og kliniske utprøvningen til en rekke doktorgrader. Som det fremgår av tabell 5 har vi registrert 60 doktorgrader i Nord-Europa i det vesentlige basert på klinisk forskning med firmaets imaging-produkter. 20 av disse er norske og bidro til et løft for norsk radiologi. Flere av disse doktorene innehar i dag professorater på norske universitet.

Den internasjonale kompetansen innen klinisk utprøvning som ble bygget opp av Klinisk FoU har kommet andre forskningsmiljøer til gode. I tråd med nedtrappingen i Oslo har en rekke av medarbeiderne gått over til andre firmaer (eks. Photocure, Clavis, Algeta, Medinnova mfl.) og bidratt til betydelig utvikling i disse. Da de første forskriftene om klinisk utprøvning kom i Norge i 1982 (5) var medarbeidere fra Klinisk FoU inne i utarbeidelsen. Medarbeidere fra Klinisk FoU har ledet Norsk Farmaceutisk Selskap i flere perioder og var sterkt delaktig i etableringen av Forum for kliniske legemiddelutprøvninger (FKLUT) i 1997. De har også deltatt i arbeidet med å lage anbefalinger for gode kliniske prøvninger og ryddige forhold innen legemiddelindustriens organisasjoner.
Medarbeidere fra Klinisk FoU tok initiativ til og en var også ansvarlig kursleder for kurs i klinisk medikamentprøvning i 1980, ‘82 og ‘85 for medisinere og farmasøyter i regi av Komiteen for farmasøytisk etterutdanning (KFFE) og Legers videre- og etterutdanning (LVE). Senere har det blitt flere etterutdanningskurs for farmasøyter. Som professor 2 på Farmasøytisk institutt, Universitetet i Oslo, i klinisk legemiddelvurdering startet Erik Andrew i 1992 det første spesialkurset (for hovedfagsstudenter) i klinisk legemiddelutprøvning på et norsk universitet.
KONKLUSJON
Historien om Klinisk FoU i Nyco/GE Healthcare for perioden 1967–2007 speiler utviklingen av kliniske legemiddelutprøvninger og av en tidligere suksessrik norsk farmasøytisk industribedrift. Grunnet forskningen med nye kontrastmidler har Klinisk FoU vært vitne til et «eventyr», både faglig og industrielt. Det har skjedd store forandringer i disse 40 årene. I begynnelsen var drivkreftene mer styrt av troen på forskning og faglig utvikling enn av økonomi, både internt i firmaet og blant utprøvere. I dag er klinisk utprøvning blitt et eget fagområde som er sterkt regulert, med kontroll og avtaler med ryddige forhold mellom sponsor og utprøvere. Nyco som en norsk farmasøytisk bedrift har fulgt den internasjonale trenden og fått utenlandsk eierskap med utflytting av hovedkontoret. Klinisk legemiddelforskning styres nå sterkere av firmastrategier enn for 40 årsiden. Internasjonal markedstenkning og krav om inntjening for eierne er vektlagt sterkere enn tidligere. Men det gjenstår å se om det toppfaglige internasjonale miljøet i Klinisk FoU noen gang vil bli gjenskapt i farmasøytisk industri i Norge.
Referanser
- Amdam RP, Sogner K. Rik på kontraster. Nyegaard & Co – En norsk farmasøytisk industribedrift 1874–1985. Ad Notam Gyldendal 1994
- Bjørnson O. Nyegaard & CO 100 år. Farmakoterapi 1974; 3
- Backe-Hansen K. Statens legemiddelkontroll 20 år – En jubileumsberetning. Falch Hurtigtrykk, Oslo 1994
- Enger E. Kontrollerte kliniske forsøk, Universitetsforlaget, Oslo 1966
- Forskrifter om kliniske legemiddelutprøvninger, Oslo 1982
(Publisert i NFT nr. 3/2008 side 15–16.)
