Optimalisering av den immundempende behandlingen etter nyretransplantasjon
Doktoravhandling
Tittel
Tools to optimize the immunosuppressive treatment after renal transplantation.
ISSN 1501-7710 / No. 2298
Veiledere
Anders Åsberg, Avdeling for transplantasjonsmedisin, Oslo universitetssykehus Rikshospitalet; Karsten Midtvedt, Avdeling for transplantasjonsmedisin, Oslo universitetssykehus Rikshospitalet; Ida Robertsen, Seksjon for farmakologi og farmasøytisk biovitenskap, Farmasøytisk institutt, Universitetet i Oslo (UiO) og Hege Christensen, Seksjon for farmakologi og farmasøytisk biovitenskap, Farmasøytisk institutt, UiO.
Sted og tidspunkt for disputas
Universitetet i Oslo, høst 2020
Hovedbudskap
En ny blodprøvetakingsmetode muliggjør dosetilpasning av takrolimus kun ved bruk av en bloddråpe.
En farmakokinetisk modell kan bestemme systemisk eksponering av takrolimus ved bruk av tre blodkonsentrasjoner.
Systemisk eksponering av takrolimus blir påvirket av doseringstidspunkt og matinntak.
En kombinasjon av verktøy kan benyttes i oppfølgingen av nyretransplanterte for å evaluere hvordan de tar sine immundempende medisiner.
Bakgrunn og hensikt
I Norge gjennomføres det årlig mellom 250 og 300 nyretransplantasjoner. Livslang immundempende behandling er nødvendig for å unngå at immunforsvaret angriper den transplanterte nyren. Normalt gis en kombinasjon av immundempende. Pasienter som venter på en nyretransplantasjon, øker hvert eneste år. Dette doktorgradsarbeidet besto av tre delprosjekter med fokus på å optimalisere den immundempende behandlingen etter nyretransplantasjon.
Kalsineurinhemmeren takrolimus er en viktig del av den immundempende behandlingen. Doseringen er utfordrende, da takrolimus har et smalt terapeutisk vindu, med avstøtningsreaksjoner ved for lave konsentrasjoner, samt alvorlige bivirkninger som nyretoksisitet og diabetes ved for høye konsentrasjoner. I tillegg kan dosebehovet variere inntil 20 ganger mellom pasienter. Legemiddelmonitorering er derfor helt nødvendig. Dette gjøres ved å måle blodkonsentrasjonen rett før en ny dose inntas, kalt bunnkonsentrasjon. Da dosebehovet også kan endre seg innad i en pasient, må doseringen jevnlige følges opp og korrigeres. Blodkonsentrasjonen måles derfor flere ganger i uken tidlig etter transplantasjon, før det gradvis reduseres til hver måned eller minimum hver tredje måned.
Hensikten med det første delprosjektet (1) var å undersøke en ny blodprøvetakingsmetode som kun behøver en bloddråpe fra fingeren. Dette muliggjør innhenting av blodkonsentrasjoner på andre tidspunkt enn kun bunnkonsentrasjoner.
Selv med takrolimus bunnkonsentrasjoner innenfor terapeutisk vindu er det fortsatt noen pasienter som opplever avstøtningsreaksjoner og alvorlige bivirkninger. Det har derfor blitt foreslått at systemisk eksponering, målt ved arealet under tids-blodkonsentrasjons-kurven (AUC), er en bedre markør for effekten av takrolimus (2). I delprosjekt 1 (1) og 2 (3) ble en farmakokinetisk matematisk modell, som beskriver hva som skjer med takrolimus i kroppen, benyttet for å estimere AUC.
Uavhengig av om pasienten får en optimal individualisert dose, betyr ikke dette noe om pasienten ikke tar de immundempende medisinene som avtalt. Lav adherence til den immundempende behandlingen er en av hovedårsakene til avstøtninger etter nyretransplantasjon (4). Frem til nå har ikke adherence-data blitt innhentet og vurdert. I delprosjekt 3 (5) var målet å evaluere verktøy for innhenting av nyretransplanterte pasienters adherence til den immundempende behandlingen, for implementering i et kvalitetsregister.
Materiale og metoder
Alle prosjektene har blitt gjennomført på Oslo universitetssykehus, Rikshospitalet, på voksne nyretransplanterte pasienter som bruker takrolimus som en del av sin immundempende behandling.
Delprosjektet 1 besto av en 12-timers farmakokinetisk undersøkelse av takrolimus. Pasientene ble inkludert tidlig etter transplantasjon og gjennomførte to undersøkelser. Takrolimus blodkonsentrasjoner ble innhentet 12 ganger i løpet av doseintervallet, både ved bruk av standard venøs blodprøve og ved bruk av kapillære fingerblodprøver. De ulike blodprøvetakingsmetodene ble sammenliknet gjennom hele doseintervallet. I tillegg ble en farmakokinetisk modell benyttet for å estimere AUC.
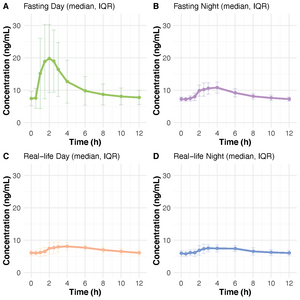
Delprosjekt 2 besto av en 24-timers farmakokinetisk undersøkelse av takrolimus morgen- og kveldsdose. Pasientene ble inkludert tidlig etter transplantasjon, og halvparten av pasientene gjennomførte to undersøkelser. Takrolimus blodkonsentrasjoner ble innhentet 26 ganger i løpet av 24 timer. Både doseinntak tatt fastende (± 2 timer) og med samtidig matinntak (frokost/middag ± 1 time før/etter dosering) ble undersøkt. Doseinntak i relasjon til mat reflekterer hvordan pasientene faktisk lever, da få pasienter tar dosen fastende. En farmakokinetisk modell ble benyttet for å beskrive forskjellen mellom morgen- og kveldsdosen, samt hvordan matinntak påvirker farmakonkinetikken. AUC ble estimert for de ulike dosesituasjonene.
I delprosjekt 3 ble en åpen randomisert kontrollert studie gjennomført på pasienter i løpet av det første året etter nyretransplantasjon. Ulike verktøy for å vurdere adherence til den immundempende behandlingen ble evaluert: et spørreskjema, lege/sykepleiers vurdering, variasjon i takrolimus bunnkonsentrasjoner og tablettelling. Prevalensen av glemte doser og tidsavvik i doseinntak ble innhentet ved bruk av de ulike verktøyene. Overlapp mellom verktøyene ble undersøkt.
Resultater
I delprosjekt 1 ble 27 pasienter inkludert. Takrolimus blodkonsentrasjoner analysert ved bruk av kapillær fingerblodprøver ble vurdert til å være tilsvarende som venøse blodprøver gjennom hele doseintervallet (6). Konsentrasjoner fra kapillær fingerblodprøver tatt 0, 1 og 3 timer etter doseinntak kunne estimere AUC.
I delprosjekt 2 ble farmakokinetikken undersøkt etter både en morgen- og kveldsdose på 31 pasienter. Ved fastende doseinntak var maks konsentrasjon og AUC høyere etter morgendosen sammenliknet med kveldsdosen (figur 1). Ved ikke-fastende doseinntak var det ingen signifikant forskjell mellom morgen- og kveldsdosen. Samtidig matinntak førte til en relativ lav AUC. Ved bruk av modellen ble AUC estimert for de ulike dosesituasjonene, men ulike konsentrasjonstidspunkt var nødvendig. Modellen måtte ta hensyn til om doseinntaket var administrert fastende eller med mat, samt om det var en morgen- eller kveldsdose.
I delprosjekt 3 ble adherence undersøkt i 295 pasienter. Dataene viste at 7–38 % av pasientene ikke tok sine immundempende medisiner optimalt, litt avhengig av hvordan dette ble definert. Ulike pasienter ble vurdert med lav adherence ut fra hvilke verktøy som ble benyttet, og overlappen mellom metodene var lav. Dataene viste at en kombinasjon av flere verktøy burde benyttes for godt nok å kunne vurdere pasientenes adherence.
Diskusjon
I klinikken justeres dosen etter bunnkonsentrasjoner av takrolimus i blod, i hovedsak på grunn av praktiske årsaker. AUC-monitorering har frem til nå vært for krevende, da flere blodkonsentrasjoner over et helt doseintervall er nødvendig. Ved bruk av modeller kan AUC blir estimert ved bruk av tre blodkonsentrasjoner, som vist i delprosjekt 1 og 2. Kapillære fingerblodprøver muliggjør måling av blodkonsentrasjoner uten at pasienten må møte opp for blodprøvetaking. Dette vil spare pasienten, men også helsevesenet, for mye tid, samtidig som det muliggjør en mer fleksibel innhenting av andre konsentrasjoner enn kun bunnkonsentrasjoner. Ingen studier har til nå sammenliknet takrolimus-monitorering ved bruk av bunnkonsentrasjoner opp mot AUC, og sett hvordan dette påvirker klinisk utfall. Kapillære fingerblodprøver og modeller vil kunne forenkle gjennomføringen av slike studier.
Hvis slike modeller skal benyttes i klinisk praksis, må de kunne beskrive det som faktisk skjer i virkeligheten. Dataene til å bygge slike modeller er ofte basert på velstrukturerte kliniske utprøvinger med fastende data. Derfor ble det i delprosjekt 2 utført en 24-timers undersøkelse på fastende- og ikke-fastende data, som bedre reflekterer virkeligheten. Resultatene viste at det var en forskjell i farmakokinetikken avhengig av doseringstidspunk (morgen/kveld), som var størst ved fastende inntak. At matinntak påvirker farmakokinetikken, er forventet og har tidligere blitt beskrevet (7). Likevel viser studien i delprosjekt 2 viktigheten av å vite om pasienten har tatt dosen fastende eller ikke, spesielt dersom takrolimus skal bli monitorert ved bruk av AUC.
Innhenting av adherence-data er svært utfordrende. I studiesammenheng benyttes ofte elektronisk monitorering, som har blitt sett på som en gullstandard (8). Elektronisk monitorering er likevel ikke et verktøy som kan implementeres i klinikken, på grunn av logistikk og høye kostnader. Resultatene i delprosjekt 3 viste at for å få et så riktig mål på adherence som mulig, må en kombinasjon av verktøy benyttes. Dette er i enighet med tidligere publiseringer (8). Det vil likevel alltid være en viss usikkerhet ved innhenting av adherence-data, da det er svakheter med alle metoder, som risikerer at en del pasienter ikke blir fanget opp. Noen av adherence-verktøyene som ble evaluert i delprosjekt 3 har nå blitt implementert i Norsk Nyreregister (9). Registeret samler årlig inn en rekke kliniske kovariater. Nå som adherence også blir inkludert, vil vi på sikt kunne studere hvordan lav adherence påvirker klinisk utfall. Videre vil studier som ser på hvilke intervensjoner som burde implementeres på pasienter med lav adherence være nødvendig.
En viktig begrensing ved disse arbeidene er at alle dataene er innhentet i løpet av det første året etter transplantasjon, og det kan derfor være vanskelig å ekstrapolere resultatene til lengre tid utover det første året.
Konklusjon
Resultatene i disse arbeidene bidrar med verktøy som kan være med på å optimalisere den immundempende behandlingen, samt gi pasientene en forbedret oppfølging. Dette kan potensielt forbedre langtidsutsiktene etter en nyretransplantasjon.
Referanser
- Gustavsen MT, Midtvedt K, Vethe NT et al. Tacrolimus Area Under the Concentration Versus Time Curve Monitoring, Using Home-Based Volumetric Absorptive Capillary Microsampling. Ther Drug Monit 2020; 42: 407–14.
- Brunet M, van Gelder T, Åsberg A et al. Therapeutic Drug Monitoring of Tacrolimus-Personalized Therapy: Second Consensus Report. Ther Drug Monit 2019; 41: 261–307.
- Gustavsen MT, Midtvedt K, Robertsen I et al. Fasting Status and Circadian Variation Must be Considered When Performing AUC-based Therapeutic Drug Monitoring of Tacrolimus in Renal Transplant Recipients. Clin Transl Sci 2020; 13: 1327–35.
- Sellarés J, de Freitas DG, Mengel M et al. Understanding the causes of kidney transplant failure: the dominant role of antibody-mediated rejection and nonadherence. Am J Transplant 2012; 12: 388–99.
- Gustavsen MT, Midtvedt K, Lønning K et al. Evaluation of tools for annual capture of adherence to immunosuppressive medications after renal transplantation – a single-centre open prospective trial. Transpl Int 2019; 32: 614–25.
- Vethe NT, Gustavsen MT, Midtvedt K et al. Tacrolimus Can Be Reliably Measured With Volumetric Absorptive Capillary Microsampling Throughout the Dose Interval in Renal Transplant Recipients. Ther Drug Monit 2019; 41: 607–14.
- Bekersky I, Dressler D, Mekki Q. Effect of time of meal consumption on bioavailability of a single oral 5 mg tacrolimus dose. J Clin Pharmacol 2001; 41: 289–97.
- Schäfer-Keller P, Steiger J, Bock A et al. Diagnostic accuracy of measurement methods to assess non-adherence to immunosuppressive drugs in kidney transplant recipients. Am J Transplant 2008; 8: 616–26.
- Norsk Nyreregister. Oslo universitetssykehus, Rikshospitalet.
(Publisert i NFT nr. 2/2021 side 37–39)
