T-cellers immunfunksjon reguleres av cAMP og type I PKA
Doktoravhandling
Tittel
Modulation of T cell immune function by cAMP and type I protein kinase A
ISBN 978-82-8264-051-0
Emne
Immunologi
Stipendiat
Randi Mosenden, Bioteknologisenteret og
Det medisinske fakultet,
Universitetet i Oslo
randi.mosenden@gmail.com
Veiledere
Prof. Kjetil Taskén og dr. Knut Martin Torgersen, Bioteknologisenteret, Universitetet i Oslo
Forsvar av oppgaven
2010, høst
Hovedbudskap
T-celler beskytter mot infeksjoner og kreft, men overaktive T-celler gir autoimmune sykdommer.
Syklisk AMP og type I PKA regulerer T-cellenes aktivitet.
Ved å påvirke cAMP-type I PKA signaleringen kan vi styrke beskyttelsen mot infeksjoner og kreft eller dempe autoimmunitet.
Randi Mosenden
Bioteknologisenteret og Det medisinske fakultet, Universitetet i Oslo
E-post: randi.mosenden@gmail.com
BAKGRUNN OG HENSIKT
T-celler er hvite blodceller som dannes i beinmarg og modnes i thymus. De patruljerer i sirkulasjonen og samles i lymfeknuter, hvor de aktiveres i møte med antigener fra kroppsfremmede agens som bakterier, virus og kreftsvulster. T-celler spesifikke for et utall ulike antigener finnes, og når en T-celle gjenkjenner sitt antigen, deler den seg raskt og gir opphav til mange like T-celler, som returnerer til blodet via lymfen for å bekjempe invasjonen. Etter at angrepet er overvunnet forblir noen av disse T-cellene i kroppen, slik at en ny invasjon med det samme fremmedstoffet kan bekjempes raskt og effektivt.
T-cellen aktiveres når T-cellereseptorene på overflaten binder til antigene peptider på overflaten til en målcelle. Dette gir signaloverføring over cellemembranen og inn til kjernen. Transkripsjon av gener og produksjon av proteiner igangsettes, og cellen deler seg og skiller ut cytokiner, en type signalstoffer som stimulerer andre T-celler og immunceller til å ekspandere og angripe fremmedstoffet. Noen T-celler utvikler seg til cytotoksiske T-celler, som dreper infiserte celler, andre til T-hjelpeceller, som gjennom sekresjon av cytokiner stimulerer immunresponsen.
T-celler er sentrale i det ervervede immunforsvaret. Imidlertid kan svikt i mekanismene som holder T-cellene i sjakk gi autoimmun sykdom som type 1-diabetes og reumatoid artritt. Det intracellulære signalmolekylet cAMP og dets målenzym type I PKA utgjør en av disse kontrollmekanismene (1). Syklisk AMP dannes intracellulært etter binding av ulike signalmolekyler til reseptorer på T-celleoverflaten. Engasjering av T-cellereseptorene i seg selv gir også dannelse av cAMP. Man antar at dette er en negativ tilbakekontrollmekanisme som avverger hyperreaktive og dermed potensielt autoimmune T-celler. Syklisk AMP hever terskelen for signalering gjennom T-cellereseptoren via type I PKA, Csk og Lck. Vi har studert denne signalveien med tanke på å dempe den ved sykdommer hvor styrket T-cellefunksjon er ønskelig, som hivinfeksjon og kreft, eller styrke den når T-cellene er overaktive, som ved autoimmunitet.
MATERIALE OG METODER
Humane T-celler ble isolert fra blod. Transgene mus ble laget ved hjelp av molekylære metoder og pronukleær injeksjon. T-celler ble isolert fra milt og lymfeknuter fra disse musene. Molekylære, biokjemiske- og cellebiologiske metoder, konfokalmikroskopi og væskestrømscytometri ble benyttet for å studere T-cellene på mekanistisk og funksjonelt nivå. Mann-Whitney U test ble utført for å vurdere styrken i observerte forskjeller.
RESULTATER
Syklisk AMP påvirker mange biologiske prosesser via flere forskjellige målenzymer. Spesifisitet sikres ved at målenzymene uttrykkes i varierende grad i ulike celletyper. For eksempel er type I PKA det viktigste målenzymet i T-celler. På cellenivå bidrar lokale gradienter av cAMP, dannet ved subcellulær forankring av enzymer som danner og bryter ned cAMP og orientering av målenzymer mot bestemte substrater ved hjelp av A-kinase ankerproteiner til spesifisitet (1). Vi har identifisert A-kinase ankerproteinet Ezrin i såkalte lipidflåter i T-cellemembranen, hvor det forbinder type I PKA med Csk via to proteiner kalt EBP50 og PAG. Fjerning av Ezrin ved hjelp av RNAi bryter den dempende virkningen av cAMP på T-celler, og viser dermed at forankring av type I PKA via Ezrin er avgjørende for normal T-cellefunksjon (2).
Det forankringsbrytende peptidet RIAD utkonkurrerer binding av type I PKA til A-kinase ankerproteiner (3 og figur 1). Vi lagde transgene mus som uttrykker RIAD i T-celler. Siden den dempende cAMP-type I PKA-Csk signalveien er frakoblet er T-cellene til disse museneufølsomme for cAMP og hyperreaktive. Musene har bedret motstand mot muse-aids etter infeksjon med et virus som gir immunsvikt ved å indusere intracellulær cAMP-produksjon. Videre vokser implanterte kreftceller dårlig på de RIAD-transgene musene. Disse funnene understreker cAMP-type I PKA-Csk signalveien som mål for immunstimulerende behandling ved hivinfeksjon og kreft.
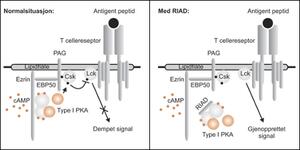
Figur 1. I en normal T-celle hindrer cAMP utilsiktet aktivering via en signalvei som involverer type I PKA, Csk og Lck. Ved sykdommer hvor det er ønskelig å styrke T-cellefunksjonen kan den hemmende effekten av cAMP brytes ved hjelp av RIAD.
Ved opprettholdt engasjering av T-cellereseptorene dannes en ansamling av signaleringsproteiner, blant annet Ezrin, EBP50 og PAG, ved motsatt pol av cellen (4). Vi har observert at også type I PKA og Csk translokaliserer, og foreslår at dette kan være en mekanisme som fjerner den dempende cAMP-type I PKA-Csk signalveien fra T-cellereseptorene og dermed er nødvendig for å tillate T-celleaktivering. Videre ser type I PKA ut til å spille en rolle i selve dannelsen av distal pol komplekset, siden en type I PKA antagonist hemmer translokasjon.
Vi har også karakterisert interaksjonen mellom Ezrin og EBP50 og utforsket muligheten for å skru av den dempende cAMP-type I PKA-Csk signalveien ved å bryte denne interaksjonen i stedet for interaksjonen mellom type I PKA og Ezrin. Et peptid som tilsvarer den Ezrin-bindende delen av EBP50 forskyver Ezrin fra T-cellemembranen og reverserer den dempende effekten av cAMP på T-celler (5).
DISKUSJON
Vi har studert cAMP og type I PKA som en av mekanismene som regulerer T-celler og et mulig angrepspunkt for ny terapi ved hivinfeksjon og kreft på den ene siden og autoimmune sykdommer på den andre. Hivinfeksjon er assosiert med gradvis tap av T-hjelpeceller, som ender med generell immunsvikt (aids) og død. T-celler fra hivpasienter har økte nivåer av cAMP. Motsatt induserer cAMP hiv replikasjon. Slik inngår cAMP i en ond sirkel (6). I dag behandles hivinfeksjon med en kombinasjon av tre antivirale midler; vanligvis to nukleosid revers transkriptasehemmere kombinert med en ritonavir-boostret proteasehemmer eller efavirenz (7). Denne behandlingen bedrer kliniske, virale og immunologiske parametre hos hivpasienter og forsinker utviklingen av aids. Likevel utryddes ikke viruset, som ligger inkorporert i immuncellenes genom som latent provirus. Det finnes altså ingen kur for hivinfeksjon, og den krever livslang, strengt etterlevd behandling. Resistensutvikling, utbredte interaksjoner med andre legemidler og alvorlige bivirkninger påvirker også langtidsprognosen. Terapistrategier som søker å bedre funksjonen til det sviktende immunforsvaret til hivpasienter kan gjøre det i stand til å drive viruset ut fra sine reservoarer slik at de antivirale midlene kan nå det. De RIAD-transgene musene har styrket T-cellefunksjon og bedret motstand mot muse-aids, en modell for cAMP-mediert immunsvikt. RIAD opphever den dempende effekten av cAMP på signalering nedstrøms for T-celle-reseptoren også i humane T-celler. For økt relevans til hivinfeksjon vil RIAD i videre studier bli injisert i mus hvis immunforsvar er erstattet med et humant immunforsvar som kan infiseres med hiv.
Mens RIAD utkonkurrerer forankring av type I PKA via A-kinase ankerproteiner generelt og dermed kan gi bivirkninger, er interaksjonen mellom Ezrin og EBP50 mer spesifikk for den immundempende cAMP-type I PKA-Csk signalveien i T-celler og dermed et lovende mål i søket etter småmolekylære forbindelser som kan bryte denne signalveien.
Vi observerer også redusert vekst av implanterte tumorer i RIAD-transgene mus sammenlignet med villtype kontroller. Dette kan skyldes av T-cellene som angriper kreftcellene i disse musene er ufølsomme overfor regulatorisk T-celle-mediert hemming. Regulatoriske T-celler er en undergruppe T-celler som demper aktiviteten til effektor T-celler og andre immunceller.En av mekanismene for regulatorisk T-celle-mediert hemming er induksjon av cAMP nivåene i effektor T-cellene (1).
KONKLUSJON
Syklisk AMP demper T-cellers immunfunksjon via type I PKA og Csk. Vi har kartlagt hvordan denne signalveien er posisjonert intracellulært for å kunne utøve sin virkning. Videre har vi brutt signalveien i ulike ledd; mellom type I PKA og A-kinase ankerproteinet Ezrin og mellom Ezrin og EBP50 og vist at dette er en lovende strategi for å styrke T-cellefunksjonen ved hivinfeksjon og kreft.
Referanser
- Mosenden R, Taskén K. Cyclic AMP-mediated immune regulation – overview of mechanisms of action in T cells. Cell Signal 2010; doi: 10.1016/j.cellsig.2010.11.018.
- Ruppelt A, Mosenden R, Grönholm M et al. Inhibition of T cell activation by cyclic adenosine 3’, 5’-monophosphate requires lipid raft targeting of protein kinase A type I by the A-kinase anchoring protein Ezrin. J Immunol 2007; 179: 5159–5168.
- Carlson CR, Lygren B, Berge T et al. Delineation of type I protein kinase A-selective signaling events using an RI anchoring disruptor. J Biol Chem 2006; 281: 21535–21545.
- Shaffer MH, Dupree RS, Zhu P et al. Ezrin and moesin function together to promote T cell activation. J Immunol 2009; 182: 1021–1032.
- Stokka AJ, Mosenden R, Ruppelt A et al. The adaptor protein EBP50 is important for localization of the protein kinase A-Ezrin complex in T cells and the immunomodulating effect of cAMP. Biochem J 2009; 425: 381–388.
- Aandahl EM, Aukrust P, Skålhegg BS et al. Protein kinase A type I antagonist restores immune responses of T cells from HIV-infected patients. FASEB J 1998; 12: 855–862.
- Norsk legemiddelhåndbok for helse-personell 2010, www.legemiddelhånd-boka.no (søkedato 14.01.2011).
(Publisert i NFT nr. 2/2011 side 26–27.)
