Blandbarhet mellom legemidler og TPN ved Y-infusjon til barn
Vigdis Staven
Institutt for farmasi, Universitetet i Tromsø (UiT)
E-post: vigdis.staven@uit.no
BAKGRUNN OG HENSIKT
Y-infusjon av legemidler og total parenteral ernæring (TPN) er aktuelt i tilfeller med begrenset intravenøs tilgang og hvor flere legemidler med lang infusjonstid og frekvent dosering skal gis samtidig med TPN. Inkompatibilitet kan medføre destabilisering av fettemulsjonen i TPN-blandingen og/eller partikulær utfelling. Det er mangel på kompatibilitetsstudier tilpasset barn.
Hensikten med oppgaven var å utvikle metoder for å teste fysikalsk-kjemisk kompatibilitet mellom TPN og legemidler, samt å gjøre innledende tester med én TPN-blanding og relevante legemidler, begge i doser beregnet for store barn.
MATERIALER OG METODER
Trekammerposen Olimel® N5E (Baxter) ble testet i blandinger med deksametason (0,5 mg/ml), fosfenytoin (10 mg/ml), furosemid (2 mg/ml), ondansetron (0,2 mg/ml) og paracetamol (10 mg/ml). Blandingsforhold i Y-settet ble beregnet ved å sammenlikne infusjonshastigheten til legemiddel og TPN for barn på henholdsvis 10, 20, 30, 40 og 50 kg (1–4). Simulering av Y-infusjon ble gjort ved å blande legemiddel og TPN i sentrifugerør. Umiddelbart og fire timer etter blanding ble prøvene testet med hensyn til dråpevekst i fettemulsjonen og dannelse av partikulære utfellinger i vannfasen, se figur 1 for metoder.
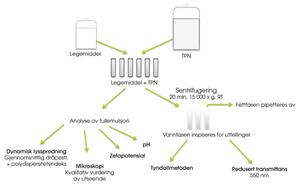
Figur 1. Testoppsettet.
RESULTATER
Gjennomsnittlig dråpestørrelse og polydispersitetsindeks forble uendret etter blanding. Zetapotensialet lå mellom -30 til -50 mV, noe som indikerer en stabil TPN-emulsjon (5). Ingen betydelige forandringer i utseende ble observert under mikroskop. Kun små endringer i pH ble målt i TPN-blandingen etter blanding med legemiddel; unntak fosfenytoin som ga en økning på to pH-enheter. Det ble ikke observert tegn til utfelling.
DISKSUSJON
Resultatene indikerer at legemidlene er kompatible med TPN-blandingen i testede konsentrasjoner og blandingsforhold. Liknende resultater er funnet i andre kompatibilitetsstudier for disse legemidlene. For fosfenytoin har undertegnede ikke funnet tilgjengelige litteraturdata. Metodene i denne oppgaven hadde noen svakheter: Det var vanskelig å fjerne hele fettfasen etter sentrifugering, dette medførte at prøvene var i overkant turbide, noe som vanskeliggjør vurdering av utfelling. Det er dessuten ønskelig med en metode som bedre detekterer en eventuell økning i andelen store fettdråper.
KONKLUSJON
De testede legemidlene så ut til å være kompatible med den utvalgte TPN-blandingen i de konsentrasjoner og blandingsforhold som ble testet. Det er imidlertid nødvendig å videreutvikle metodene og gjøre flere tester før man kan trekke endelige konklusjoner.
Referanser
- British National Formulary for Children, http://bnfc.org/bnfc/ (søkedato 06.12.2010).
- Barnelegeforeningen. Blandetabell store barn, www.legeforeningen.no/id/75463.0 (søkedato 15.11.2010).
- ESPEN Guidelines, www.espen.org/espen guidelines.html (søkedato 10.11.2010).
- ESPGHAN Guidelines, www.espghan.med. up.pt/ (søkedato 10.11.2010).
- Driscoll DF, Etzler F, Barber TA et al. Physicochemical assessments of parenteral lipid emulsions: light obscuration versus laser diffraction. Int JPharm 2001; 219: 21–37.
Takk til Kompetansenettverket for lege-midler til barn for økonomisk støtte, og Ingrid Grønlie, Barneklinikken Haukeland og Richard Fjellaksel, Sykehusapoteket Tromsø, for faglig råd og innspill.
(Publisert i NFT nr. 3/2012 side 24.)
