Bioekvivalens og medisinsk likeverdighet
Før et generisk (likeverdig) legemiddel settes på byttelisten, vurderer Statens legemiddelverk om legemidlene er bioekvivalente og medisinsk likeverdige. I denne artikkelen gjør vi rede for hvilke krav Legemiddelverket stiller til legemidler som tas inn på byttelisten. Det er sjelden de generiske legemidlene i seg selv er årsak til bivirkninger eller behandlingssvikt. Nesten alle problemer ved likeverdig bytte skyldes feilbruk av legemidlene. Bytteordningen sammen med trinnpris bidrar til vesentlig lavere legemiddelpriser i Norge.
Bjørg Nitteberg-Sørensen

Bjørg Nitteberg-Sørensen
Foto: Legemiddelverket
Steinar Madsen

Steinar Madsen: Foto: Legemiddelverket
Tekst: Bjørg Nitteberg-Sørensen, overlege og
Steinar Madsen, avdelingsoverlege, Statens legemiddelverk
Regelverk
Generiske legemidler kan komme på markedet når eneretten til å selge originallegemidlet går ut. Originallegemidlet har patentbeskyttelse eller markedsføringsbeskyttelse som gir minst ti års enerett på markedet. Alle legemidler, både originallegemidler og generiske legemidler, godkjennes etter et felles, europeisk regelverk. Alle ordninger med likeverdig bytte er nasjonale ordninger og følger et nasjonalt regelverk.
Godkjenning er utgangspunktet
Alle legemidler som tas inn på byttelisten må ha markedsføringstillatelse i Norge. Markedsføringstillatelse kommer alltid foran vurderingen av byttbarhet.
Krav til kvalitet
Det stilles samme krav til kvalitet for originallegemidler og generiske legemidler. Vurdering av kvaliteten er ofte den mest omfattende oppgaven i forbindelse med et generisk legemiddel. Legemidler med utilstrekkelig kvalitet kommer ikke på markedet. Kvalitetssvikt forekommer svært sjelden, og ikke oftere med generiske legemidler enn med originallegemidler.
Krav til virkning
Det kreves at det generiske legemidlet har samme virkning hos pasientene som originallegemidlet. Lik virkning får en erfaringsmessig dersom opptaket av de to legemidlene er tilnærmet likt. Likt opptak påvises ofte gjennom en undersøkelse av bioekvivalens. I de fleste tilfeller betyr det at det gjøres en undersøkelse av om legemidlene tas opp på samme måte av en gruppe forsøkspersoner (som kan være friske personer eller pasienter).
Bioekvivalensundersøkelser
Bioekvivalensundersøkelser utføres etter et europeisk regelverk. En vanlig undersøkelse foregår ved at to grupper forsøkspersoner vekselvis får doser av originallegemiddel og generisk legemiddel. Blodprøver som analyseres på innhold av legemiddel brukes til å beregne ulike farmakokinetiske verdier. De vanligste verdiene er: AUC (areal under tidskonsentrasjonskurven), Cmax (maksimal konsentrasjon etter en dose), Tmax (tid fra inntak av dose til Cmax oppnås) og Cmin (minste konsentrasjon etter en bestemt tid), se figur 1.
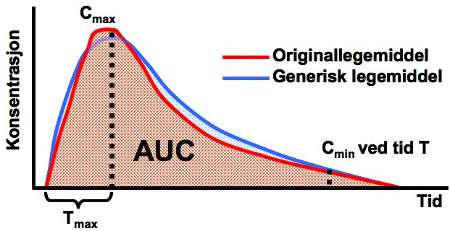
Figur 1. Vanlige målinger ved bioekvivalensundersøkelser. AUC, areal under tidskonsentrasjonskurven; Cmax , høyeste konsentrasjon i blodet; Tmax , tid til høyeste konsentrasjon oppnås; Cmin , laveste konsentrasjon i blodet ved tid T.
To legemidler anses som bioekvivalente dersom 90 prosent konfidensintervall for forholdet mellom gjennomsnittsverdiene av målingene forde to legemidlene er innenfor 0,8-1,25 (se figur 2). For å oppfylle dette statistiske kravet må det være meget god overensstemmelse mellom de to legemidlene. Forskjellene er vanligvis under 5 prosent for de vanlige målingene. Kravene medfører også at store forskjeller i opptak mellom ulike forsøkspersoner ikke kan forekomme, siden spredningen da ville bli for stor.
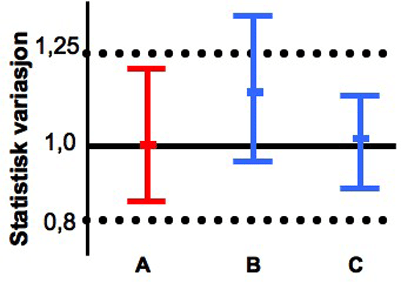
Figur 2. Eksempler på resultatet av bioekvivalensstudier. A er originallegemiddel. B er et generisk legemiddel som ikke er bioekvivalent med A (for stort avvik i gjennomsnitt og spredning). C er et generisk legemiddel som er bioekvivalent med A.
Bioekvivalensundersøkelser utformes på en slik måte at de belyser problemstillingene for det enkelte legemiddel. Minimum er enkeltdoseundersøkelse på fastende forsøkspersoner. I noen tilfeller må det gjøres undersøkelser der forsøkspersonene får legemidlet i kombinasjon med mat eller drikke for å se om dette har innflytelse på opptaket. Noen ganger er det ønskelig med studier der det gis flere doser slik at forsøkspersonene får en stabil konsentrasjon av legemidlet i blodet (steady state). Ved depotformuleringer er det viktig at Cmin ikke kommer under en viss grense i tiden mellom to doser.
De samme kriteriene for bioekvivalens gjelder når sammensetningen av et originallegemiddel endres. Da testes den nye tabletten mot den gamle.
Selv om bioekvivalensstudier ofte utføres på friske forsøkspersoner, har lang erfaring vist at det er holdbart å overføre resultatene til pasientgrupper.
Feiloppfatninger om bioekvivalens
Det har dessverre vært en utbredt misforståelse at opptaket av et generisk legemiddel kan variere mellom 0,8 og 1,25 i forhold til originallegemidlet. På bakgrunn av denne feilaktige oppfatningen har det vært hevdet at generisk bytte er utrygt fordi en kan risikere store variasjoner mellom legemidlene. Dette er ikke riktig. Alle som har hatt denne oppfatningen bør sette seg inn i metodikken for bioekvivalensundersøkelser som er beskrevet ovenfor.
Alternativer til bioekvivalensundersøkelser
I noen tilfeller kan legemidler bedømmes som likeverdige selv om det ikke er gjort bioekvivalensundersøkelser på forsøkspersoner. Bioekvivalensundersøkelse er for eksempel unødvendig når det gjelder identiske legemidler som gis rett inn en blodåre. Da er alltid opptaket fullstendig likt.
I noen tilfeller er det vanskelig eller umulig å gjøre bioekvivalensstudier. Legemidler til inhalasjon og lokal påføring er eksempler på dette. Likeverdighet kan i slike tilfeller dokumenteres gjennom kliniske studier der en sammenlikner behandlingseffekter.
I andre tifeller kan en bygge på annen dokumentasjon for å fastslå likeverdighet. Disse tilfellene vurderes særskilt nøye av Legemiddelverkets faggruppe for likeverdig bytte (Byttegruppa). Alle saker der det ikke er gjort bioekvivalensundersøkelser sendes på høring.
Medisinsk likeverdighet
Etter at Byttegruppa har vurdert bioekvivalens gjør den en vurdering av om legemidlene er medisinsk likeverdige.Denne vurderingen går ut på om det er trygt å sette legemidlene på byttelisten når en tar hensyn til andre forhold en bioekvivalens. Slike forhold kan omfatte sykdom, pasientgruppe, faren for alvorlige problemer ved uriktig bruk, behov for spesielt utstyr (injeksjonspenner, inhalasjonsutstyr) eller når små forskjeller i opptak fra pasient til pasient kan medføre uønskede endringer av behandlingseffekt eller behov for flere kontroller. Bare legemidler Byttegruppa mener er bioekvivalente og medisinsk likeverdige settes på byttelisten.
Konklusjon
Legemidlene på byttelisten er sjelden årsak til problemer. Godkjenningsordningen og kravene til opptak på byttelisten sikrer at byttbare legemidler har samme virkning som originallegemidlene. Ulempen med bytteordningen er merarbeid for leger og apotekpersonell og risiko for feilbruk hos pasientene. God informasjon til pasientene bidrar til å redusere feilbruken. I februar og mars 2009 gjennomfører Legemiddelverket en omfattende informasjonskampanje om likeverdig bytte på legekontorer og apotek.
(Publisert i NFT, nr. 2/2009 side 17–18.)
