Endocytose og intracellulær transport av FGF1 og FGF-reseptorene
Doktoravhandling
Tittel
Endocytosis and intracellular transport of FGF1 and FGF receptors
ISBN 978-82-8072-321-5
Emne
Cellebiologi/Molekylærbiologi
Stipendiat
Ellen Margrethe Haugsten, Biokjemisk avdeling, Institutt for kreftforskning, Det norske Radiumhospital og Det medisinske fakultet, Universitetet i Oslo
e.m.haugsten@medisin.uio.no
Veiledere
Prof. Sjur Olsnes og dr. Jørgen Wesche, Biokjemisk avdeling, Institutt for kreftforskning, Det norske Radiumhospital
Tidspunkt
2009, vår
Hovedbudskap
FGF1 endocyteres via forskjellige mekanismer og transporteres til ulike destinasjoner inne i cellen avhengig av hvilken av de fire FGF-reseptorene den er bundet til.
Transport av FGF1 til ulike destinasjoner inne i cellen påvirker varigheten av FGF1/FGFR-signalering.
FGF1/FGFR-signalering er involvert i mange fysiologiske prosesser og forøket FGFR-signalering kan bidra til utvikling av kreft
Ellen Margrethe Haugsten
Biokjemisk avdeling, Institutt for kreftforskning, Det norske Radiumhospital og Det medisinske fakultet, Universitetet i Oslo
E-post: e.m.haugsten@medisin.uio.no
HENSIKT
Hensikten med denne oppgaven har vært å sammenlikne opptak og transport i celler av FGF1 bundet til hver av de fire forskjellige FGF-reseptorene og videre hvilke konsekvenser disse prosessene har for FGF-signalering.
BAKGRUNN
Vekstfaktorer er signalmolekyler som binder til spesifikke sensorer eller reseptorer på celleoverflaten. Idet vekstfaktoren binder til reseptoren sendes et signal inn i cellen. Avhengig av sammenhengen kan slike signaler resultere i at cellen deler seg, beveger seg eller dør. Siden disse signalene er kritiske for en celles videre skjebne, er det viktig at signalene er nøye regulert og skrues av og på til riktig tid. Når slik signalering er ute av kontroll kan kreft og andre alvorlige sykdommer oppstå.
Fibroblast growth factor 1, FGF1, er en vekstfaktor som skilles ut av en rekke forskjellige celler og som binder til og aktiverer FGF-reseptorerer, FGFR. I mennesker finnes fire forskjellige FGFR kalt FGFR1-4. Reseptorene er transmembrane. De består av en del som stikker ut av cellen og en del som stikker inn i cytosol. FGF1 binder til den delen av reseptoren som stikker ut av cellen og dette fører til aktivering av et tyrosine kinase domene i den delen av reseptoren som er inne i cellen. Aktivering av reseptorenes tyrosine kinase domene fører til aktivering av en rekke signaleringsproteiner og signalveier inne i cellen. Tre viktige signalveier som aktiveres av FGFR er MAPK, PI3K/AKT og PLCγ/PKC. FGFR-signalering er involvert i mange fysiologiske prosesser under utvikling som i organdannelse, men også i voksne organismer ved å opprettholde homeostase og i reparasjon av vev og i dannelse av nye blodårer. Siden signalering fra FGF1 spiller en viktig rolle i mange fysiologiske prosesser er det viktig at den reguleres nøyaktig. Økt FGF-signalering kan bidra til utvikling av diverse kreftformer, blant annet prostatakreft, brystkreft og lungekreft. Andre alvorlige sykdommer som skyldes feil i regulering av FGF-signalering er blant annet dvergvekst (både chondrodysplasia og craniosynostosis syndromer), kallmann syndrom og autosomal dominant hypofosfatemisk rakitt.
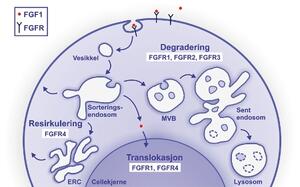
Figur 1. Endocytose og intracellulær transport av FGFR. ERC, resirkulerings-endosom, MVB, multivesikulært endosom.
Celler kan regulere signalering fra vekstfaktorer og reseptorer via en prosess kalt endocytose (se figur 1). Endocytose skjer ved at cellens overflate danner en innbuktning hvor vekstfaktoren og den aktiverte reseptoren fanges. Etter hvert avsnøres innbuktningen slik at det dannes en blære (vesikkel) som inneholder det endocyterte materialet. Vesikkelen kan deretter føre det endocyterte materiale til forskjellige destinasjoner inne i cellen. De fleste vekstfaktorer og reseptorer blir vanligvis først transportert til sorteringsendosomene. Derfra kan de bli sortert til degradering i lysosomer via multivesikulære endosomer og sene endosomer eller de kan resirkuleres enten direkte eller via resirkuleringsendosomene tilbake til celleoverflaten. Signaleringen fra de aktive reseptorene reguleres avhengig av hvor i cellen de transporteres. Sendes reseptorene til degradering i lysosomer vil signaleringen bli skrudd av mens reseptorer som resirkulerer kan fortsette å signalere.
Endocytose og intracellulær transport er nøye regulerte prosesser. Clathrin-mediert endocytose hvor blant annet proteinet clathrin rekrutteres til membranen og enzymet dynamin avsnører den innbuktede membranen er denbest karakteriserte endocytoseveien. Konjugering av ubiquitin til reseptorer har vært foreslått å fungere som en merkelapp som dirigerer reseptorer til endocytose og til degradering i lysosomer. Ubiquitin er et lite protein som bindes kovalent til aminosyren lysin i proteiner i cytosol og er vanligvis forbundet med merking av proteiner som skal degraderes i proteasomer.
MATERIALE OG METODER
Arbeidet i avhandlingen er basert på eksperimenter med celler i kultur. Celler som uttrykte ønsket FGFR-konstrukt ble generert ved transient eller stabil transfeksjon av plasmid DNA. Standard biokjemiske teknikker som gelelektroforese, western blotting, RNA-interferens, mutagenese og molekylær kloning ble benyttet. En stor del av arbeidet er basert på eksperimenter analysert med konfokal fluorescens mikroskopi.
RESULTATER
Ved å studere endocytose av FGF1 i celler som uttrykte enten FGFR1, 2, 3 eller 4 fant vi at uavhengig av hvilken reseptor FGF1 var bundet til ble FGF1 og reseptoren først transportert til sorteringsendosomer (1). Fra sorteringsendosomene ble FGF1 i celler som uttrykte FGFR1, 2 eller 3 hovedsakelig sortert til lysosomer og degradert, mens FGF1 i celler som uttrykte FGFR4 hovedsakelig ble resirkulert. Sortering til lysosomer i celler som uttrykte FGFR2 eller FGFR3 var noe mindre effektiv enn i celler som uttrykte FGFR1.
Videre undersøkte vi hvorvidt konjugering av ubiquitin til FGFR1 fungerer som et signal for endocytose og transport til lysosomer (2). Vi genererte FGFR1 mutanter som ikke kunne ubiquitineres. Disse ble endocytert like effektivt som vanlig FGFR1, men ble resirkulert i stedet for å bli sortert til lysosomer for degradering. Siden FGFR1-mutantene unngikk degradering var de aktive og signalerte lengre enn normal FGFR1. Reseptor ubiquitinering synes derfor å spille en liten rolle i endocytose av FGFR1, men er nødvendig for riktig sortering av FGFR1 og for terminering av FGFR1-signalering.
Vi fant også at FGFR3 i motsetning til FGFR1 kan endocyteres uavhengig av clathrin og dynamin (3). Fjerning av clathrin fra cellene ved bruk av RNA-interferensteknikker førte til forlenget signalering fra FGFR1 mens FGFR3-signalering var lite påvirket.
Enkelte molekyler, blant annet FGF1, kan entre cytosol ved å krysse endosom-membranen (translokere, se figur 1). Translokert FGF1 transporteres deretter til kjernen hvor den blir fosforylert. Ved å utnytte det faktum at kun translokert FGF1 blir fosforylert, undersøkte vi de fire FGFRenes evne til å mediere FGF1 translokasjon (4). Studien viste at FGF1 endocytert i celler som uttrykte FGFR1 eller FGFR4 men ikke FGFR2 eller FGFR3 kunne translokere.
DISKUSJON
Til tross for et økende antall artikler som viser at FGF-signalering er involvert i en rekke fysiologiske prosesser og under deregulering også kan bidra til utvikling av enkelte sykdommer som for eksempel kreft, er de molekylære mekanismene som regulerer FGFR-signalering lite studert. Denne avhandlingen viser at signalering fra FGF1 er langvarig eller kortvarig avhengig av hvilken reseptor FGF1 er bundet til og at dette styres av hvor i cellen FGF1 og reseptorene transporteres etter endocytose. At signaleringen fra FGF1 via de fire forskjellige reseptorene kan reguleres på denne måten, øker variasjonen i FGF1-signalering. Økt variasjon i FGF1-signalering kan bidra til at FGF-reseptorene som hovedsakelig aktiverer de samme intracellulære signalveiene kan generere svært forskjellige responser og være involvert i mange ulike fysiologiske prosesser.
Mye av det vi vet om endocytose og intracellulær transport av reseptorer kommer fra forskningpå EGFR (Epidermal growth factor reseptor) og blir ofte generalisert til å gjelde for alle reseptorer av liknende type. Det er derfor svært viktig å studere flere typer reseptorer for å vite hvorvidt mekanismene kan generaliseres eller ikke. Det er i tillegg uenighet om enkelte aspekter ved endocytosen av EGFR (som for eksempel om ubiquitinering er nødvendig for endocytose eller ikke). Studier av flere typer reseptorer kan bidra til å klare opp i slike uenigheter.
KONKLUSJON
Endocytert FGF1 transporteres til forskjellige destinasjoner inne i cellen avhengig av hvilken av de fire FGF-reseptorene den er bundet til. Konjugering av ubiquitin til FGFR1 er nødvendig for korrekt sortering av FGF1/FGFR1 til lysosomer for degradering, men ikke for endocytose. Transport av FGF1 til forskjellige destinasjoner inne i cellen bestemmer FGF-signalering.
Å forstå hvordan signaleringen fra vekstfaktorer og reseptorer blir regulert er viktig for å kunne utvikle medisiner og/eller behandling i sykdomstilfeller der signalering fra den bestemte reseptoren er ute av kontroll.
Referanser
- Haugsten EM, Sørensen V, Brech A et al. Different intracellular trafficking of FGF1 endocytosed by the four homologous FGF receptors. J.Cell Sci. 2005; 118: 3869-81.
- Haugsten EM, Małecki J, Bjørklund SMS et al. Ubiquitination of FGFR1 is required for its intracellular sorting but not for its endocytosis. Mol.Biol.Cell 2008;19: 3390-403
- Haugsten EM, Zakrzewska M, Olsnes S et al. Clatrhin- and dynamin-independent endocytosis of FGFR3. In preparation.
- Sørensen V, Więdłocha A, Haugsten EM et al. Different abilities of the four FGFRs to mediate FGF-1 translocation are linked to differences in the receptor C-terminal tail. J.Cell Sci. 2006; 119: 4332–41.
(Publisert i NFT nr. 6/2009 side 20–21.)
