Forskning på tubulinhemmere som potensielt nye anticancer-legemidler
Forskning for å utvikle nye legemidler er et sentralt tema ved Gruppe for Legemiddelkjemi, Avdeling for Farmasøytisk kjemi, Farmasøytisk institutt, UiO. Fagområdet og dets ansatte er involvert i flere spennende prosjekter, og her presenteres ett av dem, tubulinhemmer-prosjektet, nærmere.
Tekst: Stipendiat Kristin Odlo og førsteamanuensis Trond Vidar Hansen, Avdeling for Farmasøytisk kjemi, Farmasøytisk institutt, Universitetet i Oslo
Utvikling av nye legemidler er en kostbar, tid- og arbeidskrevende prosess. For å utvikle nye legemidler tar legemiddelkjemikere veldig ofte utgangspunkt i et molekyl isolert fra naturen (naturprodukt). Dette gjelder spesielt for utviklingen av nye anticancer-legemidler. Deretter utføres biologiske tester på kreftceller for å undersøke om molekylet dreper eller hemmer veksten av kreftceller, og et mål på molekylets cytotoksisitet, eller evne til å indusere celledød, bestemmes. Et eksempel på et naturprodukt med cytotoksisk effekt er combretastatin A-4, som ble isolert fra den sør-afrikanske planten Combretum caffrum på slutten av 1980-tallet. Combretastatin A-4 viser høy cytotoksisitet mot flere typer kreftceller, og spesielt god aktivitet har blitt observert mot leukemi-kreftceller.
I tillegg til cytotoksisitet er evnen et molekyl har til å hemme proteinet tubulin også viktig for en bestemt klasse av legemidler, de såkalte tubulinhemmere. Tubulin er et protein som spiller en sentral rolle for mange celleprosesser, blant annet celleorganisering og celletransport, men også celledeling (mitose). Eksempler på legemidler som er tubulinhemmere er kolkisin, paklitaxel, podofyllotoksin og vinkaalkaloidene. Combretastatin A-4 har en god evne til å hemme tubulin og dette proteinets mange funksjoner. Kombinasjonen av god tubulinhemming og høy cytotoksisitet, samt combretastatins enkle kjemiske struktur, gjør at combretastatin A-4 egner seg meget godt som utgangspunkt for utvikling av nye anticancer-legemidler. Den kjemiske strukturen til combretastatin A-4 er vist i figur 1.
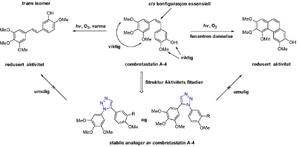
Figur 1. Kjemisk struktur av combretastatin A-4 og oversikt over struktur-aktivitetsforhold.
Combretastatin A-4 har en kjemisk ustabil cis-karbon-karbon-dobbeltbinding mellom de to aromatiske seksringene. For optimal cytotoksisitet og tubulinhemming er det nødvendig at de to aromatiske seksringene har denne bestemte cis-ordningen eller konfigurasjonen. Denne kjemisk ustabile karbon-karbon-dobbeltbindingen påvirkes av varme, oksygen og lys, slik at en mer kjemisk stabil trans-karbon-karbon-dobbeltbinding dannes. Med en trans-konfigurasjon mellom seksringene reduseres både cytotoksisitet og tubulinhemming, se figur 1. Biprodukter som fenantrener kan også dannes fra combretastatin A-4.
Vi har fremstilt en rekke nye analoge forbindelser av combretastatin A-4 ved hjelp av syntetisk organisk kjemi, hvor den kjemisk ustabile cis-karbon-karbon-dobbeltbindingen er byttet ut med en kjemisk stabil triazol femring. Vi antok at denne femringen vil være mer kjemisk stabil samtidig som den biologiske aktiviteten ivaretas. Dette fordi triazol femringen gir tilnærmet den nødvendige cis-konfigurasjonen. Vi har samtidig beholdt strukturelementene fra combretastatin A-4 som er nødvendige for både cytotoksisitet og tubulinhemming. I samarbeid med forskere både ved Farmasøytisk institutt og University of Salford har disse molekylene blitt testet mot kreftceller. Biologisk testing både for cytotoksisitet og tubulinhemming viser meget lovende resultater. Molekylmodellering ved hjelp av computerteknikker i samarbeid med Universitetet i Tromsø, viser at våre kjemisk stabile analoge forbindelser passer godt inn i den delen av tubulin der combretastatin A-4 virker som hemmer, se figur 2. Videre biologisk testing og arbeid for å øke vannløseligheten av de to analogene er vårt fokus fremover, slik at nye tubulinhemmere kanskje kan utvikles til nyeanticancer-legemidler.
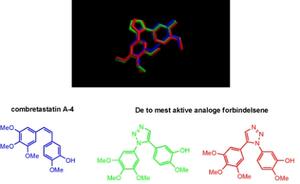
Figur 2. Kjemisk struktur av de to mest aktive forbindelsene og molekylmodellering av disse sammen med combretastatin A-4.
(Publisert i NFT nr. 7–8/2007 side 12.)
