Reformulering av orale kaptopriloppløsninger til barn basert på stabilitetsstudier
Kunnskapsgap
- Hvilke egenskaper ved formuleringen påvirker kjemisk stabilitet av kaptopril i vandige preparater?
- Hvor stor økning av holdbarhet har man oppnådd ved å reformulere kaptopriloppløsning med utgangspunkt i preparatene som produseres ved norske sykehusapotek i dag?
Før du leser videre, tenk på hvordan artikkelen skal hjelpe deg til å gjøre en bedre jobb som farmasøyt.
Hovedbudskap
Orale kaptopriloppløsninger til barn er reformulert for å oppnå økt holdbarhet av produktene.
Studier over reaksjonsmekanismer og langtidsstabilitet ligger til grunn for de nyutviklede preparatene.
Formuleringene er enkle vandige oppløsninger, kjemisk stabilisert ved sur pH og en lav konsentrasjon av Na-EDTA.
Preparatene kan produseres med en holdbarhet på inntil to år i romtemperatur og en brukstid på en måned.
Kunnskapsformidling
Hva har du lært?
Hvordan kan andre dra nytte av dette?
BAKGRUNN OG HENSIKT
Kaptopril er en av ACE-inhibitorene som hyppigst administreres til barn, og er førstevalg for nyfødte og spedbarn ved behandling av hypertensjon og hjertefeil (Grenier et al. 2000). I Norge er kaptopril kun markedsført i tablettform, og sykehusapotekene fremstiller derfor orale kaptopriloppløsninger for å tilby en fleksibel doseringsform som kan gis til barn og spedbarn. Preparatene er imidlertid svært ustabile, og produseres i dag med en holdbarhet på kun fire måneder ved kald oppbevaring inkludert brukstid på fire uker etter anbrudd. Årsaken til den korte holdbarhetstiden er at kaptopril raskt brytes ned til kaptopril disulfid i vandig oppløsning (se figur 1). Nedbrytningen er initiert av frie radikaler, og forløper via komplekse mekanismer som involverer reaksjoner med O2 (autooksidasjon) og metallion-katalysert oksidasjon (Kadin 1982; Timmins et al. 1982; Connors et al. 1986).
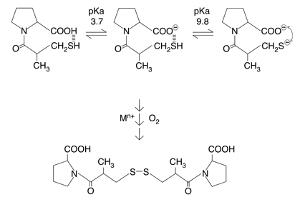
Figur 1. Nedbrytning av kaptopril til kaptopril disulfid i vandig oppløsning, via autooksidasjon (reaksjoner med O2) og metallion (Mn+)-katalysert oksidasjon av monoanionet av kaptopril.
For å kartlegge hvilken innflytelse egenskaper ved formuleringen har på kjemisk stabilitet av kaptopril, ble det satt i gang et samarbeidsprosjekt mellom Farmasøytisk institutt og Sykehusapoteket ved Rikshospitalet. Forskningsprosjektet ble utført som en hovedfagsoppgave (Lao 2004), og videreført som et pilotstudium av langtidsstabilitet av utvalgte preparatsammensetninger over to år. Resultatene av dette arbeidet ligger til grunn for videre utvikling av nye formuleringer av kaptopril oral oppløsning til barn. Langtidsstabilitet og mikrobiologisk kvalitet er nå kartlagt for to år for de nyutviklede preparatene.
Denne artikkelen har til hensikt å presentere en oversikt over resultatene av studiene som er gjort. Hovedvekt legges på de konklusjoner som kan trekkes angående formuleringsegenskapers betydning for stabiliteten av kaptopril i vandige preparater. Videre presenteres holdbarhetsdata og mikrobiologisk kvalitet av reformulerte produkter. Leseren må konferere de originale artiklene for fullstendige referanselister og detaljerte beskrivelser av metoder, resultater, beregninger, samt analyse og diskusjon rundt de konklusjoner som trekkes (Kristensen et al. 2008; Brustugun et al. In press).
MATERIALE OG METODER
Formuleringens betydning for stabilitet
Kjemisk stabilitet av kaptopril (≥ 98.6 % ren, Norsk Medisinaldepot AS) i oppløsning (pH 3) ble evaluert ved bruk av en validert, kvantitativ HPLC-metode (Brustugun et al. In press). Prøver ble oppbevart ved ulike temperaturer (5; 25; 36 °C) i 10 til 228 dager, og halveringstid (t½) og «shelf-life» (t90; uttrykt som 10 % nedbrytning) ble beregnet ved hjelp av estimerte hastighetskonstanter for observert (total) nedbrytning ut fra 0. ordens nedbrytningskurver (tilpasning til beste kinetiske modell). Stabiliteten ble evaluert som funksjon av legemiddelkonsentrasjon (1; 2.5; 5 mg/ml),temperatur, fysikalsk-kjemiske egenskaper ved oppløsningsmedium (vann, etanol, isopropanol), ionestyrke (1–100 mM NaCl), buffersalter (10 mM sitratbuffer pH 3; 10 mM fosfatbuffer pH 3), viskositet (glyserolgradient 0–80 % w/w) og konsentrasjon av metallchelator (Na-EDTA 0.1–1 mg/ml). Kompleksdannelse mellom kaptopril (0.02 mg/ml) og buffersalter ved pH 3 (1–10 mM sitratbuffer; 10–100 mM fosfatbuffer; 1–10 mM askorbatbuffer) ble studert ved UV-synlig absorpsjonsmålinger. Oksygenforbruk ble detektert ved bruk av en O2-elektrode, under nedbrytning av kaptopril (1 mg/ml) løst i 9 mM NaCl og i 10 mM sitratbuffer (begge pH 3) (Kristensen et al. 2008).
Langtidsstabilitet av kaptopril (1 mg/ml) i vandig oppløsning pH 3 ble studert ved oppbevaring ved 36 ºC i 365 dager, etter tilsetning av sorbitol (20–35 % w/v) og Na-EDTA (0.1–1 mg/ml) i kombinasjon. Halvparten av prøvene ble tilsatt N2-gass før lagring i lufttette beholdere (100 % fylningsgrad). Resten av prøvene ble lagret i lufttette beholdere med en luftlomme over væsken. Referanser ble laget med 20 % sorbitol som eneste tilsetningsstoff (Kristensen et al. 2008).
Langtidsstabilitet og mikrobiologisk kvalitet av reformulerte preparate
Langtidsstabilitet (to år) av reformulerte orale oppløsninger av kaptopril (1 og 5 mg/ml) ble evaluert ved validerte, kvantitative HPLC-analyser, pH-målinger og vurdering av utseende (farge, fellinger) i løpet av oppbevaring (0, 3, 6, 9, 12 og 24 måneder) ved 22 °C. Legemiddelet ble løst i sterilt vann, og tilsatt sorbitol 70 % (287 mg/ml), Na-benzoat (1 mg/ml), og Na- EDTA (0.1 mg/ml). pH ble ved behov justert til < 4 ved tilsetning av saltsyre. Preparatene ble fylt i 100 ml brune glassflasker med en luftlomme over væsken. Preparatene ble definert som stabile så lenge konsentrasjonen av kaptopril var ≥ 90 % av utgangskonsentrasjonen. For løsningen med styrke 1 mg/ml ble stabilitet under simulert bruk testet i løpet av fire uker under oppbevaring i kjøleskap (2–8 °C) eller romtemperatur (22 °C). Stabiliteten under simulert bruk ble testet både i starten og på slutten av testperioden. Mikrobiologisk kvalitet (bakterievekst, soppvekst, E.coli) ble testet og vurdert i henhold til farmakopémetoder (2.6.12 og 2.6.13, European Pharmacopoeia, 2004) ved tid 0, etter 6, 12, 18 og 24 måneder (1 mg/ml), eller ved tid 0 samt etter 12 og 24 måneder (5 mg/ml). Smak og lukt av preparatene ble vurdert av et testpanel på seks–ni personer (Brustugun et al. In press).
RESULTATER OG DISKUSJON
Betydning av pH, legemiddelkonsentrasjon og oppbevaringstemperatur
for stabilitet
Total (observert) oksidativ nedbrytning av kaptopril forløper via ulike komplekse radikalreaksjoner (elementærreaksjoner). Reaksjonene involverer O2 (autooksidasjon) og metallion-katalysert oksidasjon (Kadin 1982; Timmins et al. 1982; Connors et al. 1986). Elementærreaksjonene vil konkurrere, og hvilken prosess/prosesser som dominerer vil avhenge av reaksjonsbetingelser (preparatsammensetning), legemiddelkonsentrasjon og temperatur. Reaksjonsforløpet kan dessuten endre seg over tid, og det er ikke å forvente at observert (total) nedbrytning følger en heltalls reaksjonsorden (0. orden; 1. orden etc.) som er konstant over tid. Imidlertid er det en fordel å tilpasse dataene til den kinetiske modellen som passer best, slik at de eksperimentelle parameterne som studeres kan tallfestes og sammenliknes på en enkel måte. Det vil selvsagt alltid knyttes usikkerhet til slike beregninger, somevalueres ved statistisk analyse av modelltilpasning. 0.ordens reaksjonskinetikk ble valgt som beste modell for observert (total) nedbrytning av kaptopril, med god korrelasjon ved lav legemiddelkonsentrasjon (1 mg/ml) i vann ved pH 3 (R2 ≥ 0.943), men lavere korrelasjon ved høyere legemiddelkonsentrasjoner og endrede reaksjonsbetingelser. Analog konsentrasjonsavhengig reaksjonskinetikk er tidligere observert ved nøytral pH (Lee og Notari 1987), mens avvikende observasjoner skyldes ulike eksperimentelle betingelser. Dataene er presentert og diskutert i originalartikkelen (Kristensen et al. 2008).
Oksidativ nedbrytning av kaptopril i oppløsning er sterkt pH-avhengig, og optimal stabilitet oppnås ved pH ≤ 3.5 (Timmins et al. 1982; Kadin 1982). Karboksylsyren i molekylet vil protoneres ved lav pH (pKa = 3.7), og molekylet stabiliseres trolig ved at protoneringen forhindrer intramolekylær protonoverføring fra tiol gruppen (SH) til karboksylsyren (COOH) og dannelse av tiolat (S-), som er den reaktive formen av molekylet (se figur 1). Lav pH er imidlertid ikke nok for å stabilisere kaptopril i vandig oppløsning. «Shelf-life» av kaptopril 1 mg/ml i vann ved pH 3, uttrykt som tidspunkt for 10 % nedbrytning, er kun sju dager. Selv om «shelf-life» øker ved en økning av legemiddelkonsentrasjon er heller ikke dette nok til å oppnå stabile preparater (t90 = 33 dager ved 2.5 mg/ml; t90 = 54 dager ved 5 mg/ml). I tillegg kan utfelling observeres etter lagring ved 25 °C i henholdsvis 57 dager (5 mg/ml oppløsning) og 73 dager (1 og 2.5 mg/ml oppløsninger). Identiteten av utfellingen er ikke bestemt.
«Shelf-life» av kaptopril 1 mg/ml i vandig oppløsning (pH 3) øker fra sju dager ved oppbevaring i romtemperatur (25 °C) til 26 dager ved oppbevaring i kjøleskap (5 °C), og reduseres til fire dager når temperaturen er økt til 36 °C. Kaptopril er mindre følsom for temperaturendringer enn mange aktuelle legemidler (Yoshioka og Stella 2000). Aktiveringsenergien er lav (Ea = 10.2 kcal/mol), og Q10 verdien (faktoren som hastighetskonstanten for oksidativ nedbrytning endres med ved en 10 °C endring i temperatur) er kun 1.8. Kjølig oppbevaring kombinert med lav pH gir derved ikke tilstrekkelig økning av holdbarhet.
Betydningen av formuleringsegenskaper for stabilitet
Fordi kaptopril i oppløsning ikke kan stabiliseres kun ved lav pH, optimal legemiddelkonsentrasjon og kald oppbevaring, er det behov for kunnskap om hvilken innflytelse ulike egenskaper ved formuleringen har på legemiddelstabiliteten. For å studere reaksjonsmekanismer er det nødvendig å inkludere reaksjonsbetingelser (preparatsammensetninger) som ikke nødvendigvis kan benyttes ved videre reformulering av preparatet.
Løsningsmiddelets evne til å danne hydrogenbindinger og gi fra seg og motta protoner (amfiprotiske egenskaper; Kamlet et al. 1983) ser ut til å være viktig for stabiliteten av kaptopril. Stoffet brytes raskest ned i vann (sterk proton donor), men er mer stabilt i løsningsmidler med gode proton akseptor egenskaper (etanol, isopropanol). Årsaken kan være at løsningsmiddelets evne til å avgi protoner er avgjørende for dannelsen av hydroksyl-radikaler (HO.) og kaptopril-radikaler (RS.) samt hydrogen peroksid (H2O2) under den kjemiske nedbrytningen av kaptopril. Disse reaktive forbindelsene fører til videre (akselerert) nedbrytning av legemiddelet via oksidative prosesser. Metallion-katalyserte reaksjoner som initierer dannelse av frie radikaler ser ut til å være viktigstereaksjonsvei, siden tilsetning av Na-EDTA effektivt stabiliserer kaptopril løst i vann (ikke detekterbar nedbrytning etter oppbevaring i 10 dager ved 36 ºC, mot halveringstid på 21 dager uten tilsetning av Na-EDTA). Vannkvalitet og innholdet av metallioner i farmasøytiske råvarer (inklusive kaptopril API) vil derved være avgjørende for preparatets stabilitet. Analyse av innsamlede data indikerer at løsningsmiddelets polaritet og viskositet har mindre betydning for legemiddelstabilitet. Derimot kan mediets evne til å fange opp frie radikaler være viktig. Isopropanol er et løsningsmiddel som har denne egenskapen, og halveringstiden av kaptopril løst i dette mediet er tredoblet i forhold til i vann.
Kaptopril brytes ned som funksjon av økende ionestyrke ved sur pH (positiv primær kinetisk salteffekt). Halveringstiden av kaptopril ved 36 °C reduseres inntil 24 % når mediet endres fra rent vann (ionestyrke ~ 0) til fortynnet saltløsning (1–10 mM), og reduseres 62 % i 100 mM saltoppløsning sammenliknet med nedbrytningen i rent vann. Beregninger bekrefter at den reaktive forbindelsen i det hastighetsbestemmende trinnet er monoanionet av kaptopril (se også figur 1). Tilsetning av hjelpestoffer som består av salter i vandige formuleringer vil føre til akselerert nedbrytning av kaptopril ved positiv primær salteffekt, trolig ved solvatisering av frie radikaler og andre forbindelser som deltar i kjedereaksjonene.
Sitratbuffer og fosfatbuffer (pH 3) katalyserer nedbrytningen av kaptopril også utover den positive primære salteffekten (henholdsvis 33 % og 20 % reduksjon av halveringstid i forhold til bufferfri saltoppløsning med samme ionestyrke). Årsaken kan være avgivelse av protoner og økt nedbrytning via radikaldannelse, som beskrevet over. I tillegg har vi ved UV-synlig absorpsjonsmålinger påvist at det dannes et kompleks mellom kaptopril og sitrat/sitronsyre, som også kan ha betydning for stabiliteten av kaptopril. Forbruket av O2 som ble målt under nedbrytning av kaptopril i saltvann og sitratbuffer er tilnærmet identisk, til tross for ulik nedbrytningshastighet. Dette bekrefter at legemiddelet brytes ned via flere reaksjonsveier, avhengig av hjelpestoffer tilsatt formuleringen. Kompleksdannelse ble også påvist fotometrisk mellom kaptopril og antioksidanten askorbat/askorinsyre (pH 3). Vi studerte ikke stabiliteten av kaptopril etter tilsetning av askorbatbuffer fordi komplekset som ble dannet påvirket HPLC-analysene. Askorbat/askorbinsyre brytes imidlertid ned i oppløsning (fotometrisk deteksjon), og bør brukes med forsiktighet når stabilitetsdata ikke foreligger. Det er interessant å notere seg at dagens kaptopril-formuleringer inneholder både sitratbuffer og askorbinsyre. Nedbrytningen av kaptopril akselereres derved som følge av positiv primær salteffekt og bufferkatalyse. Kompleksdannelse mellom kaptopril-buffer og kaptopril-antioksidant kan også destabilisere preparatet, i tillegg til produkter (frie radikaler) som dannes ved nedbrytningen av antioksidanten.
Nedbrytningen av kaptopril i nærvær av glyserol øker med økende glyserolkonsentrasjon opp til 50 %, for deretter å avta i 80 % glyserol. Glyserol er en sukkeralkohol som kan fremme dannelse av enkelte frie radikaler og hydrogenperoksid under nedbrytningsreaksjonene, ved avgivelse av protoner som beskrevet over. Ved høy glyserolkonsentrasjon (80 %) er det sannsynlig at den høye viskositeten blir dominerende, noe som resulterer i nedsatt nedbrytningshastighet. Sukkeralkoholen sorbitol har tilsvarende destabiliserende effektpå kaptopril, men mangler viskositetseffekten ved konsentrasjonene som benyttes (20–35 %). Langtidsstabilitet (et år) av kaptopril 1 mg/ml vandig oppløsning (pH 3) lagret ved 36 °C viser at sorbitol (20 %) akselererer nedbrytningen av kaptopril (eks. 51 % nedbrutt etter 15 dager oppbevaring i nærvær av sorbitol versus 34 % i vann). Lav konsentrasjon Na-EDTA (0.1 mg/ml) var tilstrekkelig for å stabilisere preparatet (6 % nedbrutt etter 365 dager ved 36 °C). Tilsetning av N2-gass er uten betydning for stabiliteten så lenge Na-EDTA er tilsatt, bortsett fra en liten effekt ved tilsetning av høy konsentrasjon (35 %) av sorbitol.
Utvikling av reformulerte preparater samt testing av langtidsstabilitet og mikrobiologisk kvalitet
Basert på resultatene fra studiene over ble det utviklet nye formuleringer av kaptopril oral oppløsning, uten tilsetning av sitronsyre, Na-sitrat og askorbinsyre. De reformulerte preparatene besto av kaptopril (1 mg/ml og 5 mg/ml) løst i sterilt vann til injeksjonsvæske, tilsatt sorbitol 70 % (287 mg/ml) som søtningsmiddel og Na-benzoat (1 mg/ml) som konserveringsmiddel (se tabell 1). Preparatene var videre stabilisert med Na-EDTA for å redusere metallion-katalysert oksidativ nedbrytning av virkestoffet samt saltsyre til pH < 4 for å protonere og derved stabilisere legemiddelmolekylet mot oksidativ nedbrytning. Konsentrasjonen av Na-EDTA var 0.1 mg/ml, hvilket er 1:10 av konsentrasjonen som tidligere er dokumentert effektiv (Berger-Gryllaki et al. 2005). Preparatene var fylt i 100 ml brune glassflasker og ble oppbevart ved romtemperatur (22 °C). Konsentrasjonen av kaptopril var ≥ 98.5 % gjennom hele det første året, og preparatene tilfredsstiller derved kravet til akseptabel kjemisk stabilitet med god margin (i vårt studium definert som ≥ 90 % av utgangskonsentrasjonen). Kaptopriloppløsningen med styrke 1 mg/ml holdt seg stabil i fire uker med simulert bruk (2–8 °C), både på begynnelsen (første måned) og slutten (siste måned) av testperioden (≤ 0.5 % nedbrytning). Mikrobiologisk kvalitet (bakterievekst, soppvekst, E.coli) tilfredsstilte kravene i den europeiske farmakopeen gjennom hele testperioden, og endringene i pH var minimale (< 0.1 pH-enhet). Løsningene forble fargeløse og klare (ingen utfellinger), men det sterkeste preparatet (5 mg/ml kaptopril) fikk en svak lukt og smak av svovel som kan skyldes dannelse av nedbrytningsproduktet kaptopril disulfid i svært små mengder (≤ 1.5 % virkestoff nedbrutt).
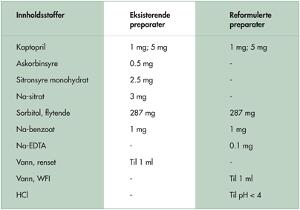
Tabell 1. Sammensetning av orale kaptopriloppløsninger før og etter reformulering
Studien av løsningenes langtidsstabilitet i romtemperatur fortsatte til preparatene totalt hadde vært lagret i 24 måneder. Preparatene var kjemisk stabile og mikrobiologisk holdbare i hele perioden – konsentrasjonen av kapropril var ≥ 97% ved studiens slutt, pH-verdien hadde endret seg lite (< 0.1 pH-enhet) og det ble ikke funnet mikrobiell vekst. Det ble funnet at lukt og smak av løsninger med styrke 5 mg/ml hadde utviklet seg ytterligere i ugunstig retning – holdbarhetstiden bør derfor begrenses oppad til ett år. Stabilitet under simulert bruk i romtemperatur ble dokumentert for en periode på én måned ved studiens slutt.
Kaptoprilmikstur brukes i behandlingen av hjertesyke barn og det er i enkelte kilder påpekt at man generelt bør vise forsiktighet ved administrasjon av Na-EDTA til pasienter medhjertesykdom (Rowe et al. 2003). Dette forholdet innbyr til en særlig vurdering. Det første som skal påpekes er at Na-EDTA også tidligere har blitt brukt i kaptoprilpreparater til den samme pasientgruppen. Capoten Oral Solution (BMS) som tidvis har vært tilgjengelig fra Australia har inneholdt stoffet. En annen kaptoprilløsning for nyfødte og spedbarn har de siste fem årene vært i bruk i Sveits og denne løsningen har inneholdt Na-EDTA i ti ganger høyere konsentrasjon enn i miksturen som har vært gjenstand for vår studie (Berger-Gryllaki et al. 2005). Det er ikke urimelig å tenke seg at advarselen mot bruk av Na-EDTA ved hjertesykdom gjelder intravenøs bruk. Ved intravenøs chelatorterapi gis stoffet i en pediatrisk dose på 40 mg/kg/dag (Produktinformasjon Endrate 1999) mens ved bruk av den foreliggende orale løsningen vil inntaket gjerne ligge på noen få tiendels milligram per døgn. I denne sammenheng skal det også nevnes at opptaket ved oral administrasjon er svært lavt (Lanigan og Yamarik 2002). WHO har anbefalt en øvre grense ved oralt inntak av EDTA på 2.5 mg/kg/døgn (Whittaker et al. 1993). Skjønt anbefalingen ikke er spesielt myntet på barn er det verdt å merke seg at inntaket ved bruk av den foreliggende orale kaptoprilløsningen vil ligge på under en tidel av denne mengden – og oftest lavere. En helhetsvurdering tilsier at bruk av Na-EDTA i den aktuelle orale løsningen er forsvarlig.
KONKLUSJON
Reformulerte orale oppløsninger av kaptopril (1 mg/ml og 5 mg/ml) som er stabilisert med en lav konsentrasjon av Na-EDTA (0.1 mg/ml) ved sur pH (< 4) er kjemisk og mikrobiologisk stabile i inntil to år ved oppbevaring i romtemperatur (22 °C). Oppløsningen med styrke 5 mg/ml bør imidlertid få en begrenset holdbarhet (til ett år) på grunn av smaksendring. Preparatene er også stabile under bruk i inntil fire uker ved romtemperatur (22 °C).
Oppgitte interessekonflikter: Ingen
Referanser
Berger-Gryllaki M, Podilsky G, Widmer N et al. (2005) Formulation optimization in a university hospital: The example of pediatric solutions of the ACE inhibitor captopril. Chimia 59: 357–358.
Brustugun J, Lao Y, Brænden J et al. (in press) Long-term stability of captopril oral liquids. AJHP
Connors KA, Amidon GL, Stella VJ (1986) Chemical stability of pharmaceuticals, John Wiley & Sons, New York, p. 82–105, 284–289.
European Pharmacopoeia, 5th ed., vol. 1. Council of Europe, Strasbourg, France; 2004: 154–161.
Grenier MA, Fioravanti J, Truesdell SC et al. (2000) Angiotensin-converting enzyme inhibitor therapy for ventricular dysfunction in infants, children and adolescents: a review. Pediatr Cardiol 12: 91–111
Kadin H (1982) Captopril. In: Florey K (ed.) Analytical profiles of drug substances, Vol. 11, Academic Press, New York, p. 79–137.
Kamlet MJ, Abboud J-LM, Abraham MH et al. (1983) Linear solvation energy relationships. 23. A comprehensive collection of the solvatochromic parameters π*, α and β, and some methods for simplifying the generalized solvatochromic equation. J Org Chem 48: 2877–2887.
Kristensen S, Lao YE, Brustugun J et al. (2008) Influence of formulation properties on chemical stability of captopril in aqueous preparations. Pharmazie 63: 872–877.
Lanigan RS, Yamarik TA (2002) Final report on the safetyassessment of EDTA, Calcium Disodium EDTA, diammonium EDTA, Dipotassium EDTA, Disodium EDTA, TEA-EDTA, Tetrasodium EDTA, Tripotassium EDTA, Trisodium EDTA, HEDTA, and Trisodium HEDTA. Int J Toxicol. 21 (5) Suppl. 2: 95–142
Lee T-Y, Notari RE (1987) Kinetics and mechanisms of captopril oxidation in aqueous solution under controlled oxygen partial pressure. Pharm Res 4: 98–103.
Lao YE (2004) Stabilitet av kaptopril i flytende orale formuleringer; effekt av ulike formuleringsparametre og oppbevaringsbetingelser. Hovedfagsoppgave, Farmasøytisk institutt, Universitetet i Oslo.
Produktinformasjon Endrate ® (1999) Edetate disodium injection. Abbot Laboratories, North Chicago, IL, USA.
Rowe RC, Sheskey PJ, Weller PJ (2003). Handbook of pharmaceutical excipients, 4th ed., Pharmaceutical Press, London, p. 225–228.
Timmins P, Jackson IM, Wang Y-C J (1982) Factors affecting captopril stability in aqueous solution. Int J Pharm 11: 329–336.
Whittaker P, Vanderveen JE, Dinovi MJ et al. (1993) Toxicological profile, Current use, and Regulatory issues on EDTA compounds for assessing use of Sodium Iron EDTA for food fortification. Reg Toxicol Pharm 18: 419–427.
Yoshioka S, Stella VJ (2000) Stability of drugs and dosage forms, Kluwer Academic/Plenum Publisher, New York, p. 61–66.
Manuskriptet ble mottatt 13. februar 2009 og godkjent 2. juli 2009.
Fagredaktør Ingunn Tho.
Norsk Farmaceutisk Tidsskrift 2009; 9: 20–3.
