T-celler styrer kroppens immunsystem
Doktoravhandling
Tittel
Positive and negative regulation of T cell responses by Lck-dependent signaling pathways
Emne
Immunologi, cellesignalering
Stipendiat
Trond Methi
Universitetet i Oslo
methi.trond@gmail.com
Hovedveileder
Professor Kjetil Taskén, M.D., Ph.D.,
Bioteknologisenteret i Oslo,
Universitetet i Oslo
Disputas
Mars 2008
Hovedbudskap
Presis regulering av T-cellesignalering er nødvendig for optimal immunrespons.
Dysregulering av T-celler kan resultere i immunsvikt, autoimmunitet eller utvikling av kreft.
Tyrosinkinasen Lck regulerer T-celler både positivt og negativt.
Trond Methi
Universitetet i Oslo
E-post: methi.trond@gmail.com
INTRODUKSJON
Forløpere til T-celler dannes i beinmargen, og modnes til funksjonelle T-celler i tymus. Modne T-celler fungerer som mellommenn i det adaptive immunforsvaret, og regulerer kroppens forsvar mot kreftceller og invaderende mikroorganismer. Aktivering av T-celler skjer ved at T-cellereseptoren (TCR) reagerer på fremmede antigener, som er prosesserte fragmenter av bakterier, virus eller kreftceller (se figur 1). På denne måten patruljerer T-cellene kroppens lymfe- og blodåresystemer kontinuerlig på jakt etter infiserte eller kreftbefengte celler som må angripes og utryddes for at kroppen skal overleve.
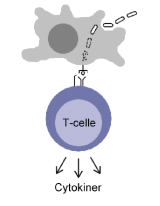
Figur 1. En antigenpresenterende celle, f.eks. en makrofag, spiser og fortærer en bakterie, og presenterer antigener fra bakterien til T-celler for inspeksjon. Fremmede antigener aktiverer T-celler, som så utskiller cytokiner, som igjen regulerer immunsystemets videre respons mot infeksjonen.
På innsiden av T-cellene finnes proteinet Lck. Lck er en tyrosinkinase i Src-familien som spiller en viktig rolle i signaloverføringen fra stimulering av TCR til igangsettelse av et cytokinproduserende maskineri i T-cellene (se figur 2). Cytokiner er små kommunikasjonsmolekyler, eksempelvis interleukiner og interferoner, som skilles ut og forteller de andre cellene i kroppens forsvarssystem hva de skal gjøre for å bekjempe en infeksjon. Dette kan være B-celler som produserer antistoffer, makrofager som spiser opp bakterier, eller cytotoksiske T-celler og NK-celler som angriper virusinfiserte celler og kreftceller. På denne måten er immunsystemet under streng kontroll fra T-cellene, og dette forhindrer uhemmede immunreaksjoner og vevsskade.
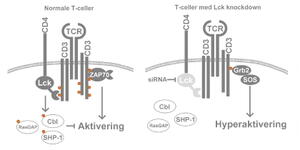
Figur 2. I normale T-celler fosforyleres T-cellereseptorkomplekset (TCR) av Lck når TCR trigges av et fremmed antigen. Dette leder til aktivering av T-cellen. Denne aktiviteten balanseres samtidig av negative feedback-mekanismer for å unngå for kraftig respons. I T-celler med siRNA-mediert Lck-knockdown er mengden Lck redusert, og dermed også fosforyleringsgraden av TCR. Dette trigger en alternativ signaleringsmekanisme som gir opphav til hyperaktivering av T-cellene. Hyperaktiveringen oppstår ettersom de normale negative feedback-mekanismene er avhengige av fullt operativ Lck for å fungere. Slik dysregulering kan gi opphav til bl.a. autoimmune sykdommer.
Hvis feil oppstår i T-cellenes respons kan kroppen bli mer mottakelig for sykdom (immunsvikt), eller det motsatte: immunforsvaret reagerer for kraftig på ufarlige stimuli eller kroppens egne celler (utvikling av allergi eller autoimmunitet). Immunsvikt oppstår eksempelvis ved hivinfeksjon hvor nettopp T-cellene angripes, mens diabetes og reumatiod artritt er eksempler på autoimmunes sykdommer.
HENSIKT
Doktoravhandlingens hensikt har vært å kartlegge hvilke molekylære mekanismer som ligger til grunn for regulering av T-cellesignalering. Mer presist har vi ønsket å undersøke tyrosinkinasen Lck nærmere, og hvordan dette proteinet regulerer T-cellers aktivitet.
MATERIALE OG METODER
For å undersøke intracellulære signalmekanismer brukes molekylære og biokjemiske arbeidsmetoder, herunder gelelektroforese av proteiner,westernblotting, konfokal mikroskopi og ELISA-baserte cytokinassays. Særlig er den relativt nye teknologien basert på short interfering RNA (siRNA)-mediert knockdown nyttig. Ved hjelp av korte 21 nukleotid RNA-baserte fragmenter kan proteinekspresjon slås ned post-transkripsjonelt (se figur 3 og 4). Andrew Fire og Craig Mello fikk nobelprisen i 2006 for oppdagelsen av denne teknologien.
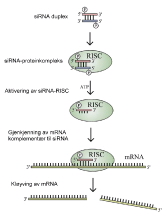
Figur 3. Mekanismen for siRNA-mediert knockdown.
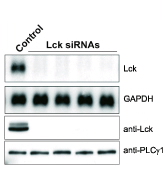
Figur 4. Knockdown av Lck ved hjelp av siRNA. Her vises både reduksjon av Lck mRNA og Lck proteinet med fire forskjellige Lck-siRNA. GAPDH og PLC fungerer som interne kontroller.
HOVEDFUNN
Reduksjon av Lck i T-celler ved hjelp av siRNA resulterer i paradoksal hyperaktivering av T-celler (se figur 2 og ref. 1). Et kompleks bestående av Grb2-SOS1 rekrutteres til T-cellereseptoren i celler med Lck-knockdown, og medfører langvarig aktivering av cellene (ref. 2–3). Samtidig er Lck nødvendig for igangsettelse av negative feedback-mekanismer, slik som aktivering av fosfatasen SHP-1, ubiquitinligasen Cbl og Ras-inhibitoren Ras-GAP (ref. 1–3).
TOLKNING
Lck er en sentral mediator av T-cellesignalering. siRNA-mediert Lck-knockdown medfører likevel hyperaktivering av T-celler. Dette indikerer at T-cellene har alternative backup aktiveringsmekanismer, men også at feilkobling av det molekylære maskineriet i T-celler kan resultere i skadelige responser. Lck er nødvendig for trigging av en rekke negative regulatorer av T-cellesignalering, blant annet SHP-1, Ras-GAP og Cbl. Fravær av slike negative feedback-mekanismer muliggjør hyperaktivering i T-celler med reduserte mengder Lck. Våre funn understreker at signaleringsveiene i T-celler er non-lineære og mer kompliserte en tidligere antatt. Lck er ikke bare viktig for overførig av positive aktiveringssignaler, men igangsetter samtidig negativ signalering. Ytterligere innsikt i intracellulær signaltransduksjon er nødvendig for å forstå immunologiske responser, og for å kunne utvikle effektive farmakologiske terapier mot sykdommer der immunsystemet spiller en rolle. Dette gjelder både infeksjonssykdommer, hiv/aids, autoimmune sykdommer, bekjempelse av kreft og utvikling av kreft i immunceller (leukemi).
KONKLUSJON
Lck fungerer både som positiv og negativ regulator av T-cellesignalering. Alternativ og paradoksal hyperaktivering kan spille en rolle i utviklingen av autoimmune sykdommer og kreft, hvor nettopp ulike former for feil i T-cellesignalering er av betydning. T-cellers intracellulære molekylære maskineri er svært komplekst, og er avhengig av finjustert regulering. Denne reguleringen er nødvendig for å kunne respondere på det utall av mikrobiologiske trusler i form av bakterier, virus og parasitter som finnes i våre omgivelser, og faren for utvikling av kreft i kroppens egne celler.
Referanser
- Methi T, Ngai J, Mahic M, et al. Short-interfering RNA-mediated Lck knockdown results in augmented downstream T cell responses. J.Immunol. 2005; 175:7398-7406.
- Methi T, Ngai J, Vang T, et al. Hypophosphorylated TCR/CD3zeta signals through a Grb2-SOS1-Ras pathway in Lck knockdown cells. Eur. J. Immunol. 2007; 37:2539-2548.
- Methi T, Berge T, Torgersen KM, et al.Reduced Cbl phosphorylation and CD3-zeta degradation in T cells with low Lck levels. Submitted to Eur. J. Immunol. 2008.
(Publisert i NFT nr. 6/2008 side 18–19.)
