Ubiquitin kontrollerer endocytose av reseptor for epidermal vekstfaktor
Doktoravhandling
Tittel på doktoravhandling
Ubiquitination in Control of EGF Receptor Endocytosis
ISBN: 978-82-8072-774-9
www.duo.uio.no/sok/work.html?WORKID=88891
Emne
Cellebiologi/Molekylærbiologi
Stipendiat
Vibeke Bertelsen, Institutt for Patologi, Universitetet i Oslo
vibeke.bertelsen@rr-research.no
Veiledere
Prof. dr. med. Inger Helene Madshus, Institutt for Patologi, UiO
Dr. philos. Espen Stang, Institutt for Patologi, UiO
Disputas
2009, vår
Hovedbudskap
Reseptor for epidermal vekstfaktor (EGFR) er involvert i cellevekst, celledeling og differensiering.
Regulering av EGFR på celleoverflaten er viktig for å opprettholde normal cellevekst, celledeling og differensiering.
Proteinet ubiquitin regulerer nivået av EGFR på celleoverflaten.
Tekst: Vibeke Bertelsen, Institutt for Patologi, Universitetet i Oslo
BAKGRUNN
Vekstfaktorer og vekstfaktorreseptorer danner grunnlag for et komplisert signaliseringsnettverk i cellene og er av stor betydning for viktige cellulære prosesser, slik som cellevekst, celledeling og differensiering. En viktig gruppe vekstfaktorreseptorer er reseptortyrosinkinaser, deriblant reseptor for epidermal vekstfaktor, EGFR (også kjent som ErbB1/HER1).
I tillegg til å kontrollere normal cellevekst er endret uttrykk og/eller aktivering av EGFR funnet i en rekke kreftformer. Dette kan skyldes overuttrykk av EGFR som følge av genamplifikasjon, mutasjoner som fører til konstitutiv aktivering og/eller defekt nedregulering av EGFR (1). EGFR er derfor en attraktiv kandidat for biologisk målrettet kreftterapi.
EGFR blir aktivert etter binding av vekstfaktorer som epidermal vekstfaktor (EGF). Aktivering resulterer i fosforylering på spesifikke seter i EGFR etterfulgt av rekruttering av proteiner involvert i signalisering inne i cellene. For å unngå ukontrollert differensiering og celledeling, et kjennetegn ved kreft, er det således viktig at signaliseringsnettverket er nøye regulert og at signaliseringen opphører etter en viss tid. En viktig måte hvorved signalisering fra EGFR blir stoppet er nedregulering av aktivert EGFR fra plasmamembranen ved clathrin-avhengig endocytose etterfulgt av lysosomal degradering av reseptoren (se figur 1). Selv om endocytose og degradering av EGFR har vært studert i en årrekke, er den eksakte mekanismen og hvilke proteiner som er involvert i prosessen fortsatt ikke fullstendig klarlagt.
Når EGFR er aktivert av EGF rekrutteres blant annet adaptorproteinet Grb2 og ubiquitinligasen Cbl, og proteinet ubiquitin blir kovalent konjugert til EGFR (se figur 2). Konjugering med ubiquitin, ubiquitinering, er vist å være essensielt for lysosomal degradering av EGFR, men hvorvidt ubiquitinering er viktig for endocytose av EGFR er fortsatt i stor grad omdiskutert (2).
HENSIKT
Hensikten med denne doktoravhandlingen har vært å studere hvilke proteiner som er involvert i de initielle trinnene i endocytosen av EGFR og hvorvidt ubiquitinering spiller en rolle i endocytosen av EGFR.
MATERIALE OG METODER
Arbeidet i avhandlingen er basert på eksperimenter på celler i kultur. For å analysere posttranslasjonelle modifikasjoner som fosforylering og ubiquitinering er det benyttet standard biokjemiske teknikker, slik som gelelektroforese av proteiner og westernblotting. EGFR endocytose er studert både ved bruk av radioaktivt konjugert EGF og av fluorescens-merket EGF etterfulgt av konfokal fluorescensmikroskopi. Protein-protein interaksjoner er analysert ved hjelp av immunpresipitering av proteiner fra cellelysater, og lokalisering av EGFR i clathrin-anrikede områder på plasmamembranen er analysert ved elektronmikroskopi. I tillegg er det benyttet «RNA interference» (RNAi) for å nedregulere proteiner av interesse for senere å studere om de er involvert i konjugering av ubiquitin og/eller endocytose av EGFR.
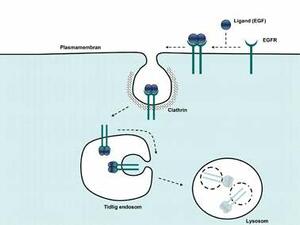
Figur 1. Binding av ligand som f.eks. EGF, fører til dimerisering av EGFR. Dette komplekset blir konsentrert i clathrin-anrikede områder på plasmamembranen. EGFR blir tatt inn i cellen ved at disse områdene invaginerer og snøres av fra plasmamembranen og danner tidlige endosomer. EGFRblir videre sortert til indre vesikler på endosomene. Endosomene fusjonerer til slutt med lysosomer hvor EGFR blir degradert.
RESULTATER
Ved elektronmikroskopi viste vi at behandling med EGF fører til at EGFR blir konsentrert i clathrin-anrikede områder på plasmamembranen, og at denne prosessen er avhengig av adaptorproteinet Grb2 og ubiquitinligasen Cbl (3). Videre viste vi at når EGFR ikke ubiquitineres blir den ikke konsentrert i clathrin-anrikede områder og heller ikke tatt inn i cellen ved endocytose (3, 4).
Ved immunpresipiteringsanalyser fant vi at adaptorproteinet epsin binder til ubiquitinert EGFR og ved bruk av RNAi og tømming av cellene for epsin, oppdaget vi at epsin er viktig både for rekruttering av EGFR til clathrin-anrikede områder på plasmamembranen og for endocytose av EGFR (5). Ved bruk av rekombinant DNA- teknologi festet vi ubiquitin til enden av EGFR, og viste at konjugert ubiquitin er tilstrekkelig som signal for clathrin-avhengig endocytose av EGFR.
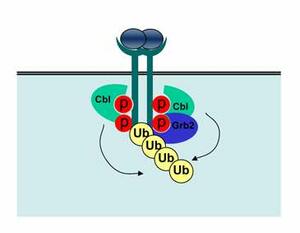
Figur 2. Binding av EGF fører til aktivering av EGFR og fosforylering (p) av spesifikke seter på EGFR. Dette fører videre til binding av Cbl og Grb2. Cbl er en ubiquitinligase og medierer konjugering av ubiquitin (Ub) til EGFR.
DISKUSJON
Som nevnt tidligere er mekanismen for endocytose av EGFR ikke fullstendig klarlagt. Siden EGFR er involvert i så mange ulike former for kreft og derfor er et attraktivt mål for biologisk målrettet kreftterapi, er det viktig å få bedre innsikt i den eksakte molekylære mekanismen for nedregulering av EGFR fra plasmamembranen.
Det diskuteres hvilke proteiner som er involvert i denne prosessen, samt hvilke posttranslasjonelle modifikasjoner som er nødvendig for endocytose.
Selv om det i noen grad er uenighet i litteraturen synes det som om fosforylering av spesifikke tyrosiner på EGFR er nødvendig for endocytose. Mutasjoner i kinasedomenet eller fosforyleringsseter på EGFR fører til redusert endocytosehastighet, og videre kan endocytosen av EGFR effektivt blokkeres ved bruk av spesifikke tyrosinkinasehemmere (6).
På den annen side er det kontroversielt hvorvidt ubiquitinering er viktig for endocytose av EGFR. Det er tidligere vist at EGFR blir ubiquitinert før den blir tatt inn i cellen ved endocytose og at dette i tid korrelerer med lokalisering til clathrin-anrikede områder på plasmamembranen hvorfra EGFR blir endocytert (7). Dette kan indikere at ubiquitinering er involvert i konsentrasjonen av EGFR i clathrin-anrikede områder på plasmamembranen. På den annen side er det ganske nylig rapportert at konjugering av ubiquitin til EGFR ikke er nødvendig for endocytose, kun for lysosomal degradering av EGFR (8). Denne konklusjonen er basert på EGFR-mutanter som i liten grad blir ubiquitinert.
Funnene i denne avhandlingen indikerer imidlertid det motsatte, at proteinene Grb2 og Cbl er nødvendig for ubiquitinering av EGFR, og at denne posttranslasjonelle modifikasjonen er viktig for å konsentrere EGFR i clathrin-anrikede områder på plasmamembranen (3). Vi observerte gjentatte ganger en positiv korrelasjon mellom konjugering av ubiquitin og endocytose av EGFR (3, 4). At det ubiquitin-bindende proteinet epsin ble funnet å være viktig for rekruttering av EGFR tilclathrin-anrikede områder på plasmamembranen og for endocytose (5) er også en indikasjon på at ubiquitinering kontrollerer denne prosessen. Et interessant funn er at fire ubiquitin-molekyler på enden av EGFR induserer endocytose av EGFR. Til sammen viser dette arbeidet at ubiquitin kontrollerer clathrin-avhengig endocytose av EGFR.
Som tidligere nevnt er EGFR involvert i mange ulike kreftformer, og EGFR er derfor et attraktivt mål for biologisk målrettet kreftterapi. Det er i dag flere EGFR- målrettede legemidler på det norske markedet, og mange flere er under utprøving og utvikling. Bedre forståelse av hvordan uttrykket av EGFR på plasmamembranen reguleres er således nyttig for videre design og utvikling av slike medikamenter.
KONKLUSJON
Doktoravhandlingen viser at konjugering av ubiquitin til EGFR er viktig og tilstrekkelig for initielle trinn i clathrin-avhengig endocytose av EGFR, og at det ubiquitin-bindende proteinet epsin er involvert i sortering av EGFR til clathrin-anrikede områder på plasmamembranen før EGFR blir tatt inn i cellen ved endocytose.
Kunnskap om hvordan EGFR på celleoverflaten reguleres er nyttig med tanke på utvikling av EGFR-målrettet kreftterapi.
Referanser
- Zandi R, Larsen AB, Andersen P et al. Mechanisms for oncogenic activation of the epidermal growth factor receptor. Cell Signal, 2007. 19(10): p. 2013-23.
- Miranda M and Sorkin A. Regulation of receptors and transporters by ubiquitination: new insights into surprisingly similar mechanisms. Mol Interv, 2007. 7(3): p. 157-67.
- Stang E, Blystad FD, Kazazic M et al. Cbl-dependent ubiquitination is required for progression of EGF receptors into clathrin-coated pits. Mol Biol Cell, 2004. 15(8): p. 3591-604.
- Bertelsen V, Breen K, Sandvig K et al. The Cbl-interacting protein TULA inhibits dynamin-dependent endocytosis. Exp Cell Res, 2007. 313(8): p. 1696-709.
- Kazazic M, Bertelsen V, Pedersen KW et al. Epsin 1 is involved in recruitment of ubiquitinated EGF receptors into clathrin-coated pits. Traffic, 2009. 10(2): p. 235-45.
- Sorkin A and Goh LK. Endocytosis and intracellular trafficking of ErbBs. Exp Cell Res, 2009. 315(4): p. 683-96.
- Stang E, Johannessen LE, Knardal SL et al. Polyubiquitination of the epidermal growth factor receptor occurs at the plasma membrane upon ligand-induced activation. J Biol Chem, 2000. 275(18): p. 13940-7.
- Huang F, Goh LK and Sorkin A. EGF receptor ubiquitination is not necessary for its internalization. Proc Natl Acad Sci U S A, 2007. 104(43): p. 16904-9.
(Publisert i NFT nr. 4/2009 side 20–21.)
