Overvåking av immundempende legemiddelvirkning i celler fra transplanterte
Doktoravhandling
Tittel
Molecular pharmacodynamics of the immunosuppressant mycophenolic acid: A basis for monitoring and individualized treatment
Elektronisk versjon:www.duo.uio.no
Emne
Farmakologi
Stipendiat
Nils Tore Vethe, Avdeling for medisinsk biokjemi, Rikshospitalet, Oslo universitetssykehus og Institutt for klinisk biokjemi, Universitetet i Oslo
nils.tore.vethe@rikshospitalet.no
Veileder
Stein Bergan, Avdeling for medisinsk biokjemi, Rikshospitalet, Oslo universitetssykehus og Farmasøytisk institutt, Universitetet i Oslo
Forsvar av oppgaven
2009, vår
Hovedbudskap
Mykofenolats spesifikke respons kan måles i isolerte blodceller.
Effekter på enzymet IMP dehydro-genase:
- Umiddelbar, direkte hemming som er mest uttalt 0-6 timer etter dose
- Konsentrasjons- og tidsavhengig endring av basalnivået i enkelte cellepopulasjoner
- Mykofenolat mofetil 500-1000 mg gir maksimal molekylær respons
Nils Tore Vethe
Avdeling for medisinsk biokjemi, Rikshospitalet, Oslo universitetssykehus og Institutt for klinisk biokjemi, Universitetet i Oslo
E-post: nils.tore.vethe@rikshospitalet.no
BAKGRUNN OG HENSIKT
Transplanterte pasienter bruker immundempende legemidler med ulike angrepspunkter for å hindre avstøtning av det nye organet (figur 1). Underdosering kan medføre terapisvikt (avstøtning), mens overdosering øker risikoen for infeksiøse, hematologiske og maligne bivirkninger. Derfor er det viktig at den immundempende behandlingen balanseres hos den enkelte pasient.
Mykofenolat er et legemiddel som inngår i den immundempende behandlingen hos de fleste transplanterte. Mykofenolat mofetil eller enterodrasjert mykofenolat brukes oftest i kombinasjon med takrolimus eller ciklosporin i tillegg til kortikosteroider og antistoffer mot interleukin-2-reseptoren. Den immundempende virkningen skyldes at mykofenolat hemmer enzymet inosinmonofosfat (IMP) dehydrogenase i lymfocytter som potensielt kan angripe det transplanterte organet. Enzymhemmingen medfører underskudd på puriner som skal inngå i DNA og RNA, og lymfocyttenes celledeling stanser opp (1).
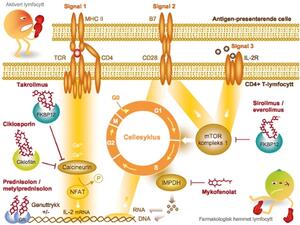
Figur 1. Virkningsmekanismer for immundempende legemidler. Tre signalveier fra overflatereseptorer sørger for immunaktiveringen av en CD4+ T-lymfocytt. Antigen fra transplantatet gjenkjennes av T-celle-reseptoren (TCR) som via calcineurin signaliserer økt produksjon av interleukin-2 (IL-2). Takrolimus binder seg til FK-bindende protein 12 (FKBP12) og ciklosporin binder seg til proteinet ciklofilin. Disse legemiddel/protein-kompleksene hemmer fosfatasen calcineurin. Signaler fra CD28 og IL-2-reseptoren på celleoverflaten stimulerer blant annet mTOR kompleks 1 som videre regulerer økt proteinproduksjon. Dermed kan proliferasjon tillates, og cellen går fra G1- til syntese (S)-fase i cellesyklus. Sirolimus og everolimus binder seg også til FKBP12, men disse legemidlene hemmer mTORs kinaseaktivitet. IMP dehydrogenase (IMPDH) er sentral i syntesen av purinbaser som skal inngå i DNA og RNA. Dette enzymet hemmes av mykofenolat. Glukokortikoidene prednisolon og metylprednisolon binder seg til den intracellulære glukokortikoidreseptoren (GR). Glukokortikoidkompleksene regulerer uttrykket av flere immunrelaterte gener.
Den overordnete hensikten med studiene har vært å skape et grunnlag for at molekylære responsmålinger kan brukes til å individualisere mykofenolatbehandlingen. Herunder var det et mål å utvikle metoder til utførelse av responsmålinger i cellepopulasjoner, samt å fremskaffe detaljert kunnskap om mykofenolats farmakokinetiske-farmakodynamiske profil.
Det er svak korrelasjon mellom dose og konsentrasjon for mykofenolat. I tillegg varierer nivået av målproteinet IMP dehydrogenase i stor grad fra pasient til pasient (2). En hypotese er derfor at hver pasients dose kan tilpasses for å oppnå balansert immundemping. Man antar da at responsmålinger vil kunne egne seg til å forutsi den kliniske effekten av legemidlet (figur 2).
MATERIALE OG METODER
Farmakologiske studier ble utført blant nyretransplanterte pasienter ved seksjonene for transplantasjonskirurgi og nyresykdommer på Rikshospitalet, samt blant friske personer og i dyrkede cellekulturer. Sentrale målevariable inkluderte plasmakonsentrasjon av mykofenolat, aktivitet oggenuttrykk (RNA) av IMP dehydrogenase, og cellulære konsentrasjoner av guanin- og adenin-nukleotider. Enkelte farmakokinetiske-farmakodynamiske sammenhenger ble estimert ved hjelp av nonlineære regresjonsanalyser. I de kliniske studiene ble ikke-parametriske statistiske tester benyttet til å vurdere individuelle endringer og forskjeller mellom grupper, mens Student t-test ble anvendt på resultater fra in vitro-studiene. Forskjeller ble regnet som signifikante dersom P-verdien var under 5 % ved tosidig test.
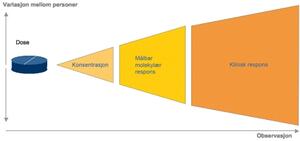
Figur 2. Immundempende legemidlers farmakokinetikk og farmakodynamikk varierer mellom personer. Genetikk, fysiologi, sykdomstilstand, diett og legemiddelinteraksjoner har innflytelse på variasjonen. Siden responsmålinger integrerer kinetikk og dynamikk er det mulig at slike målinger kan forutsi den kliniske responsen i større grad enn konsentrasjonsmålinger.
Resultater
I blodceller fra nyretransplanterte som brukte mykofenolat, økte nivået av IMP dehydrogenase med ca. 500 % i løpet av de første seks-åtte ukene etter transplantasjon. Enzymaktiviteten ble betydelig hemmet like etter hver mykofenolat-dose selv om det underliggende nivået av IMP dehydrogenase var oppregulert. Den kraftige hemmingen av IMP dehydrogenase varte i ca. seks timer etter dose (mykofenolat doseres hver 12. time) (3).
Mykofenolats evne til å endre basalnivået av IMP dehydrogenase ble videre undersøkt i dyrkede leukemiceller. Ved moderate mykofenolat-konsentrasjoner økte genuttrykket (mRNA) og den basale aktiviteten av IMP dehydrogenase, mens høye mykofenolat-konsentrasjoner reduserte nivået. De cellulære nivåene av purin-nukleotider ble redusert (4).
Vi utviklet en metode som ble brukt til å måle mykofenolats spesifikke molekylære respons. Prinsippet for denne metoden er å isolere immunceller (CD4+ T-lymfocytter) fra blod, for deretter å se i hvilken grad IMP dehydrogenase utfører oppgaven sin i disse cellene. IMP dehydrogenase katalyserer oksidasjonen av inosinmonofosfat til xantosinmonofosfat, og hastigheten på denne reaksjonen ble brukt som et mål på enzymets aktivitet. Høy konsentrasjon av mykofenolat i cellene medfører at reaksjonshastigheten blir lav. Metoden ble designet slik at nivået av mykofenolat i de isolerte cellene (ex vivo) tilsvarte nivået i blodsirkulasjonens celler (in vivo) (5).
I en studie blant friske personer ble sammenhengen mellom mykofenolats konsentrasjon og respons undersøkt i 12 timers intervaller ved fire ulike doser ([0]-100-250-500-1000 mg). Maksimal hemming av IMP dehydrogenase i CD4+ T-lymfocytter inntraff mellom 15 minutter og tre timer etter dosering av mykofenolat mofetil (85-90 % maksimal hemming ved dose ≥ 250 mg). Plasmakonsentrasjonen av mykofenolat som skulle til for å gi 50 % effekt (EC50), ble estimert til å være 2.3 mg/L. Maksimal effekt ble oppnådd ved konsentrasjoner over 6 mg/L. Totaleksponeringen og totaleffekten i 12 timers intervallet ble beregnet som arealet under variabel-tidskurven (AUC0-12t). Maksimal totaleffekt ble oppnådd ved mykofenolat AUC0-12t over 22 mg×t/L. Den direkte enzymhemmende effekten viste seg åvære assosiert med nedsatt genuttrykk av IMP dehydrogenase i de CD4+ T-lymfocyttene. Vi undersøkte også nivåene av purin-nukleotider. Disse varierte i stor grad, men de ble ikke redusert etter enkeltdosene av mykofenolat. Derimot var det en paradoksal tendens til økning av guanosintrifosfat (6).
DISKUSJON
Mykofenolat har en dobbeltrolle overfor proteinet IMP dehydrogenase. På den ene siden utøver mykofenolat umiddelbar, direkte hemming av enzymets aktivitet, og på den annen side kan legemidlet endre det cellulære nivået av proteinet. Nivåendringene henger sammen med endrede genuttrykk. Det er foreløpig ikke kjent hvordan nivåendringene eventuelt kan påvirke den kliniske effekten.
Mykofenolats effekt på IMP dehydrogenase inntreffer raskt etter dosering, og hovedtyngden av effekten vedvarer fire-seks timer. Første halvdel av doseintervallet på 12 timer er dermed mest interessant med tanke på responsmålinger hos pasienter. Guanin-nukleotider vil sannsynligvis ikke fungere som umiddelbare responsmarkører for mykofenolat, men de bør undersøkes som potensielle langsiktige markører i pasientstudier. Forholdsvis lave plasmakonsentrasjoner av mykofenolat medfører kraftig hemming av IMP dehydrogenase. Vi estimerte at 2.3 mg/L gir 50 % enzymhemming. Konsentrasjoner som måles hos pasienter like før dosen tas, ligger ofte mellom 1 og 3 mg/L (7).
Det kan være risiko for overeksponering ved maksimalkonsentrasjoner høyere enn 6 mg/L. Våre resultater tyder på at standard-doseringen av mykofenolat korresponderer til det øvre området av legemidlets responskurve. Dette kan være med på å forklare forholdsvis hyppig forekomst av gastrointestinale og hematologiske bivirkninger.
KONKLUSJON
Metoder som gjør det mulig å måle effekten av mykofenolat i lymfocytter, har blitt etablert. Mykofenolat har en dualistisk rolle overfor IMP dehydrogenase; direkte hemming og endring av underliggende nivå. Vanlig dosering av mykofenolat er i det øvre molekylære responsområdet. Responsmålinger sammen med konsentrasjonsmålinger kan hjelpe til med å identifisere over- eller underdosering, og på sikt kan det bidra til å forbedre mykofenolatbehandlingen hos transplanterte.
Referanser
- Allison AC, Eugui EM. Mechanisms of action of mycophenolate mofetil in preventing acute and chronic allograft rejection. Transplantation 2005; 80(2 Suppl): S181–90.
- van Gelder T, Shaw LM. The rationale for and limitations of therapeutic drug monitoring for mycophenolate mofetil in transplantation. Transplantation 2005; 80(2 Suppl): S244–53.
- Vethe NT, Mandla R, Line P-D et al. Inosine monophosphate dehydrogenase activity in renal allograft recipients during mycophenolate treatment. Scand J Clin Lab Invest 2006; 66(1): 31–44.
- Vethe NT, Bremer S, Bergan S. IMP dehydrogenase basal activity in MOLT-4 human leukaemia cells is altered by mycophenolic acid and 6-thioguanosine. Scand J Clin Lab Invest 2008; 68(4): 277–85.
- Vethe NT, Bergan S. Determination of inosine monophosphate dehydrogenase activity in human CD4+ cells isolated from whole blood during mycophenolic acid therapy. Ther Drug Monit 2006; 28(5): 608–13.
- Vethe NT, Bremer S, Rootwelt H et al. Pharmacodynamics of mycophenolic acid in CD4+ cells: a single-dose study of IMPDH and purine nucleotide responses in healthy individuals. Ther Drug Monit 2008; 30(6): 647–55.
- Staatz CE, Tett SE. Clinical pharmacokinetics andpharmacodynamics of mycophenolate in solid organ transplant recipients. Clin Pharmacokinet 2007; 46(1): 13–58.
(Publisert i NFT nr. 7–8/2009 side 23–25.)
