Individuell dosering av ciklosporin hos nyretransplanterte pasienter
Doktoravhandling
Tittel
Whole blood and intracellular pharmacokinetics of cyclosporine A in renal transplant recipients.
Emne
Farmakologi (farmakokinetikk)
Stipendiat
Pål Falck, Farmasøytisk institutt, Universitetet i Oslo
pal.falck@farmasi.uio.no
Veiledere
Prof. Anders Åsberg, prof. Hege Christensen og prof. Leon Reubsaet, alle fra Farmasøytisk institutt
Forsvar av oppgaven
2008, høst
Hovedbudskap
Ciklosporin er fortsatt et mye brukt immundempende legemiddel etter organtransplantasjon. Bruken kompliseres av stor pasientvariasjon og mange blodkonsentrasjonstestinger. Moderne metoder som intracellulære målinger og dataprogrammer som hjelper til med doseringen kan bidra til å optimalisere doseringen av ciklosporin.
Pål Falck
Farmasøytisk institutt, Universitetet i Oslo
E-post: pal.falck@farmasi.uio.no
BAKGRUNN OG HENSIKT
Hvert år blir ca. 220 personer nyretransplantert på Rikshospitalet i Oslo. Omtrent 40 % av donorene er levende givere, og de tre mest hyppige årsakene til at personene trenger transplantasjon er vaskulær/hypertensiv nefropati (30 %), glomerulonefritt (20 %) og diabetisk nefropati (16 %) (1). Fra 1997 til 2007 har antall pasienter i dialyse blitt fordoblet. I Norge har standard immunosuppresiv protokoll siden 2007 vært kvadrubel behandling. De fire legemidlene som inngår er induksjonsterapi med basiliximab (i.v.), mycofenolat, steroider og en lavdose kalsineirinhemmer (ciklosporin eller tacrolimus).
Ciklosporin ble oppdaget i 1970 ved at legemiddelfirmaet Sandoz ba alle ansatte ta med seg en jordprøve hjem fra eksotiske ferier. En forsker ved navn Frey besøkte Hardangervidda og tok med seg en jordprøve tilbake til Sveits. Den jordprøven inneholdt en sopp med navnet Tolypocladium infatum. Borel og Stähelin stod i 1971 bak oppdagelsen av ciklosporin sine immunosuppresive egenskaper (2, 3). Siden ciklosporin (Sandimmun®) kom på markedet i 1983 har det forbedret den immunosuppresive behandlingen betraktelig, og det er fortsatt et mye brukt legemiddel 25 år senere.
Utfordringen med ciklosporin, og annen immunosuppresiv behandling, er at dette er veldig potente legemidler på godt og vondt. Ciklosporin har et smalt terapeutisk vindu, det vil si at det er kort vei fra optimal dosering til overdosering og påfølgende bivirkninger, men samtidig også kort vei ned til underdosering og påfølgende manglende immunsuppresjon. I tillegg til dette smale terapeutiske vinduet, har ciklosporin både høy intra- og interpasientvariasjon. Dette gjør at blodnivået av ciklosporin må monitoreres nøye. I dag monitoreres ciklosporinnivået i blodet både ved å måle blodnivået rett før neste dose (trough/C0) eller to timer etter inntak av dosen (C2). De første tre månedene etter operasjon tas det prøver en–tre ganger i uken, og C2-målinger er den dominerende metoden tidlig etter operasjon.
Selv om dagens metoder er godt utprøvd er det fortsatt muligheter for optimalisering slik at risikoen for både rejeksjon og bivirkninger reduseres. Formålet med dette arbeidet har vært å optimalisere doseringen hos nyretransplanterte pasienter ved å utvikle en ny monitoneringsteknikk, studere doseringen i eldre pasienter og undersøke om en ny medisin interagerer med ciklosporin. I tillegg ble all denne informasjonen bygget inn i en datamodell som kan beregne individuell dosering av pasientene.
MATERIALE OG METODER
Dette arbeidet består av tre utførte kliniske studier, en metodeutvikling og utvikling av et dataprogram for doseberegning av pasienter. Det ble utviklet en unik metode for å måle ciklosporin der den faktisk utfører sin virkning; intracellulært i T-lymfocyttene (hvite blodceller) (4). Denne metoden ble testet i en prospektiv studie der den intracellulære konsentrasjonen hos 20 nyretransplanterte pasienter ble målt i tre måneder etter operasjonen for å undersøke sammenhengen mellom det intracellulære nivået og den kliniske effekten (5).
Hvordan eldre bør doseres ble undersøkt i en studie der eldre (> 65 år, n=11) ble sammenliknet med yngre pasienter (n= 14) (6). Det ble utført en 12-timers farmakokinetisk profil, der både fullblod og intracelluær konsentrasjon ble målt. Genotypene for det metaboliserende enzymet CYP3A5 og transporterproteinet ABCB1 ble analysert for muligpåvirkning av farmakokinetikken til ciklosporin.
Cinacalcet er et nytt legemiddel som tilbyr et nytt alternativ til behandling av posttransplantasjons hyperkalsemia og hyperparathroidisme (HPT). HPT er en vanlig komplikasjon hos pasienter med alvorlig redusert nyrefunksjon. En interaksjonsstudie ble utført for å undersøke hvordan cinacalcet påvirker farmakokinetikken til ciklosporin, tacrolimus og mycofenolat. Studiens design var at pasienter på ciklosporin (n=8) og tacrolimus (n=6) utførte en full 12-timers farmakokinetisk analyse før og etter en ukes behandling med 10 mg cinacalcet daglig.
Alle resultatene fra de ovenfor nevnte studiene ble samlet i en stor database, deretter ble denne informasjonen bygget inn i en datamodell i den farmakokinetiske programvaren NONMEM (non-linear mixed effects modeling). Denne ciklosporin-spesifikke populasjonsfarmakokinetiske modellen bruker både individuelle og populasjonsfarmakokinetiske parametere til å beregne individuell dosering. Denne modellen ble deretter testet klinisk i en studie der legene doserte 20 pasienter etter vanlig klinisk rutine, og denne gruppen ble sammenliknet med 20 pasienter som ble dosert ved beregninger gjort av denne datamodellen.
RESULTATER
Det å kunne måle ciklosporin intracellulært i lymfocytter, viste å gi tilleggsinformasjon i forhold til dagens metoder. Hos de sju pasientene som fikk rejeksjon (alvorlig betennelsesreaksjon i nyrene), ble det en uke før rejeksjon observert en nedgang i det intracellulære nivået, og tre dager før selve rejeksjonen var det intracellulære nivået signifikant lavere hos pasientene med rejeksjon enn hos tilsvarende stabile pasienter. I samme tidsperiode var det ikke mulig å se forskjell på fullblodkonsentrasjon, antall lymfocytter eller andre aktuelle parametere.
Eldre pasienter (> 65 år) viste som forventet en 26 % saktere eliminasjon av ciklosporin sammenliknet med yngre pasienter. Et annet veldig viktig funn var at de eldre pasientene hadde høyere intracellulær: fullblod konsentrasjonsratio enn de yngre. Det vil si at mer ciklosporin ble funnet intracellulært enn hos de yngre pasientene per fullblodkonsentrasjon.
Cinacalcet viste en liten signifikant, men sannsynligvis ikke klinisk interaksjon med tacrolimus. Det ble observert en nedgang i AUC (arealet under kurven) på 14 % av tacrolimus når den ble kombinert med cinacalcet. Når det gjelder kombinasjonen ciklosporin og cinacalcet, ble ikke selve ciklosporin-nivåene endret, men det ble observert en signifikant 9 % økning av en metabolitt, AM19. I tillegg ble det vist en korrelasjon mellom økte AM19 verdier og nedsatt nyrefunksjon.
Den populasjonsfarmakokinetiske datamodellen beskrev de observerte dataene godt. Den modellen som best beskrev dataene var en 2-kompartment modell med 1.-ordens absorpsjon med lag tid. Det ble funnet seks kovariater som påvirket tre farmakokinetiske parametere signifikant. Kroppsvekt påvirket absorpsjonskonstanten og det sentrale distribusjonsvolumet, tiden etter absorpsjon påvirket absorpsjonskonstanten, alder påvirket legemiddel clearance, absorpsjonskonstant og sentralt distribusjonsvolum. Genotypingen av CYP3A5 viste også en signifikant påvirkning på clearance, men ble ikke inkludert i modellen, siden den ikke alltid er tilgjengelig i den kliniske hverdagen. Studien som sammenlikner modellens evne til å dosere sammenliknet med legene i en klinisk setting er akkurat fullført. Den viste at datamodellen hadde flere blodkonsentrasjoner i det terapeutiske vinduetenn det legene hadde (data ikke publisert ennå).
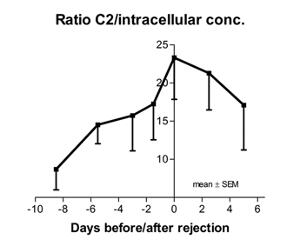
Figur 1. Forholdet mellom fullblod og intracellulær konsentrasjon hos sju pasienter som opplevde rejeksjon ved dag 0. En høy verdi vil bety lavt intracellulært nivå i forhold til fullblodkonsentrasjonen. Som figuren viser sank de intracellulære nivåene i dagene før rejeksjon, noe som til dels forklarer og gir en mulighet for tidlig intervenering med tanke på å unngå rejeksjon.
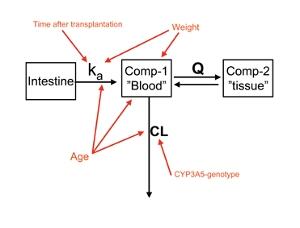
Figur 2. Figuren viser den farmakokinetiske modellen (i svart), og hvilke covariater som påvirker hvilke farmakokinetiske parametere. Ka er absorpsjonskonstanten, dvs. at den beskriver hvor raskt ciklosporin tas opp fra mage/tarm til kompartment 1, som består av blodet og andre raskt perfunderte organer (lunge og lever). Fra dette kompartmentet kan legemiddelet gå videre til vevet (comp-2) eller elimineres (CL=clearance).
DISKUSJON OG KONKLUSJON
Det gamle salgsargumentet «en dose til alle» fungerer svært dårlig for legemidler med et smalt terapeutisk vindu og høy inter- og intrapasient variasjon. Dette gjelder i høyeste grad ciklosporin, noe som har gjort fullblodsmålinger til en nødvendighet for nyretransplanterte pasienter. Selv om man har gode rutiner i dag, har pasientene fortsatt høy rejeksjonsfrekvens og plager fra overdoseringer, slik at ny kunnskap om doseindividualisering alltid vil være nyttig. Vi har funnet at konsentrasjonen inne i lymfocyttene synker tre dager før en rejeksjon, slik at man i teorien har muligheten til å intervenere tidligere enn i dag. Utfordringen er å gjøre denne metoden mer automatisk og raskere slik at den kan implementeres i den kliniske hverdagen. Dette vil kreve en videre metodeutvikling og midler til bruk av nyere utstyr.
Eldre pasienter bør få en lavere dosering enn yngre. Dette har vært en trend i klinisk praksis, men nå er det dokumentert at de har en lavere eliminasjon av legemiddelet. I tillegg har vi for første gang vist at eldre har en oppkonsentrering av ciklosporin intracellulært i lymfocyttene, slik at de vil få en «sterkere effekt per mg». Disse to egenskapene argumenterer til sammen for at eldre pasienter bør doseres lavere.
Cinacalcet er et nytt legemiddel som blir gitt til nyretransplanterte. Vår interaksjonsstudie viste at det var en liten interaksjon mellom tacrolimus og cinacalcet. I tillegg ble det vist en endring av metabolismeveien for ciklosporin ved samtidig bruk av cinacalcet. Tacrolimus-pasientene bør monitores nøye ved oppstart av behandling, og ciklosporinpasientene bør få nyrefunksjonen hyppig kontrollert, slik at en eventuell nedgang kan oppdages raskt.
En spesialutviklet datamodell kan potensielt hjelpe klinikerne å doseoptimalisere ciklosporin hos nyretransplanterte pasienter.
Referanser
- Leivestad T. Annual report 2006 – The Norwegian Renal Registry. 2006.
- Borel JF et al. Biological effects of cyclosporin A: a new antilymphocytic agent. Agents Actions, 1976. 6(4): p. 468–75.
- Stahelin HF. The history of cyclosporin A (Sandimmune) revisited: Another point of view. Experientia, 1996. 52(1): p. 5–13.
- Falck P et al. Determination of ciclosporin A and its six main metabolitesin isolated T-lymphocytes and whole blood using liquid chromatography-tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci, 2007. 852(1–2): p. 345–52.
- Falck P et al. Declining intracellular T-lymphocyte concentration of cyclosporine a precedes acute rejection in kidney transplant recipients. Transplantation, 2008. 85(2): p. 179–84.
(Publisert i NFT nr. 9/2009 side 18–19.)
