T-cellen reguleres av et komplekst signalnettverk
Doktoravhandling
Tittel
Heterotrimeric G-proteins in the regulation of TCR-signaling pathways
ISBN 978-82-8072-332-1
Emne
Immunologi/molekylær biologi
Stipendiat
Jacob Ngai, Bioteknologisenteret i Oslo, Universitetet i Oslo
Veileder
Professor Kjetil Taskén, senterdirektør Bioteknologisenteret i Oslo, Universitetet i Oslo
Forsvar av oppgaven
2009, vår
Hovedbudskap
G-proteinet Gαq regulerer aktiviteten til kinasen Lck i T-celler.
Interaksjonen mellom Gαq og Lck viser en ny molekylær mekanisme for hvordan kinaser kan bli aktivert.
Jacob Ngai
Bioteknologisenteret i Oslo, Universitetet i Oslo
BAKGRUNN
Immunsystemet er en del av kroppens forsvar mot bakterier, virus og kreftceller. T-celler er viktige regulatorer av kroppens immunrespons. Aktiveringen av T-celler skjer ved at T-cellereseptoren (TCR) på cellens overflate reagerer med fremmede fragmenter (antigener) fra bakterier, virus eller kreftceller. TCR sender et signal inn i cellen (figur 1) som aktiverer cellen og starter produksjonen av cytokiner, immunregulerende signalstoffer. Disse cytokinene vil videre kunne aktivere B-celler som produserer antistoffer, makrofager som spiser bakterier eller cytotoksiske T-celler som angriper virusinfiserte celler og kreftceller.
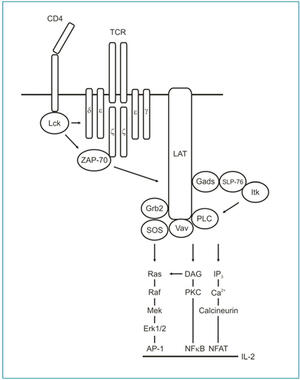
Figur 1. I T-celler blir TCR/CD3-komplekset fosforylert av kinasen Lck når TCR trigges av et antigen. Det fosforylerte TCR/CD3-komplekset rekrutterer og aktiverer kinasen ZAP-70 som videre fosforylerer adaptorproteinet LAT. LAT fungerer som en signalplattform og binder til en rekke signalproteiner. Rekrutteringen av proteiner til LAT resulterer i en signalkaskade med translokasjon av transkripsjonfaktorer til nukleus og transkripsjon av gener.
Signalet fra TCR består av mange ulike komponenter som gir mulighet til å regulere T-celleresponsen på flere nivåer. Den mest proksimale hendelsen etter TCR-stimulering er aktivering av kinasen Lck. Lck er en tyrosin kinase som fosforylerer en rekke proteiner etter TCR-stimulering og er essensiell for aktivering av T-cellen. Mekanismen bak aktivering av Lck er ikke fullstendig kartlagt til tross intens forskning. Aktivert Lck fosforylerer tyrosin-motifer i CD3-komplekset som videre starter en signalkaskade som resulterer i aktivering av T-cellen.
Korrekt regulering av T-celleresponsen er viktig for at kroppens immunforsvar skal reagere adekvat ved infeksjoner, men ikke reagere mot ufarlige antigener. Ved autoimmune sykdommer som diabetes og revmatoid artritt angriper immunsystemet kroppens eget vev grunnet en hyperaktiv immunrespons. I motsatt tilfelle, som hos pasienter med aids, observerer man en hypoaktiv immunrespons hvor hiv-infiserte T-celler ikke er i stand til å reagere mot patogener, denne tilstanden kalles for immunsvikt.
HENSIKT
Formålet med denne doktorgradsavhandlingen har vært å undersøke de molekylære mekanismene som regulerer signaltransduksjon fra TCR og dermed immunresponsen. Vi har sett på hvordan det heterotrimeriske G-proteinet Gαq, som hittil har hatt en ukjent rolle i T-cellesignallering, regulerer aktiveringen av T-cellen.
MATERIALE OG METODER
For å kartlegge rollen til Gαq i T-celler har det blitt brukt flere ulike strategier. Korte 21-nukleotid RNA-baserte fragmenter (short interfering RNA, siRNA) har blitt brukt til å «slå ned» (knockdown) proteinekspresjonen av Gαq i T-celler, dette innebærer at mengden Gαq i cellen blir redusert med opptil 90 %. Alternativt har T-celler isolert fra Gαq-knockout-mus, hvor Gαq-genet er fjernet fra musen, blitt brukt i forsøk. T-cellene fra disse musene uttrykker ikke proteinet Gαq. Peptide-array har blitt brukt for å kartlegge potensielle interaksjonsdomener. Molekylære og biokjemiske arbeidsmetoder, herunder SDS-PAGE, Western blotting og ELISA-baserte cytokin assay har blitt brukt for å analysere prøver fra forsøk.
RESULTATER
T-celler med redusert mengde Gαq viser redusert aktivering av kinasen Lck (1). Vi viser at Gαq regulerer Lck-aktiviteten via en direkte interaksjon. Interaksjonsdomenet mellom Gαq og Lck har videre blitt kartlagt ved bruk av peptide-array teknologien(upublisert data). Peptide-array gjør det mulig å printe sekvenser på 20 aminosyrer fra et protein på et filter som videre kan inkuberes med et annet protein (figur 2). Binding mellom tilsatt protein og sekvens på filter indikerer en interaksjon, og man kan ved denne metoden kartlegge et proteins interaksjondomener. Mutasjoner i interaksjonsdomenet til Gαq påvirker både interaksjonen og aktiveringsgraden til Lck. Til tross for redusert aktivering av Lck, viser både Gαq siRNA-knockdown T-celler og T-celler fra Gαq-knockout-mus hyperaktivitet etter stimulering av TCR (1).
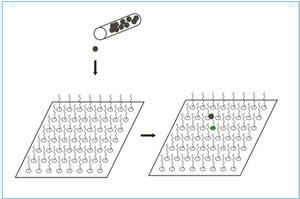
Figur 2. Ved å printe korte sekvenser fra et protein på et filter og inkubere med et annet protein er det mulig å finne interaksjonsdomenene mellom de to proteinene. Den sekvensen på filteret hvor proteinet som er i løsning binder angir interaksjonsdomenet til proteinet som er printet på filter.
DISKUSJON
En klonal TCR har den unike egenskapen at den kan gjenkjenne en rekke antigener, men aktivering av T-cellen skjer kun under betingelser hvor TCR binder til et spesifikt antigen. Dette innebærer at signalet fra TCR inn i cellen må reguleres slik at antigener som gir et for svakt signal og antigener som gir et for sterkt signal via TCR ikke fører til aktivering av T-cellen. Lck har vist å kunne aktivere både positive og negative signalveier etter TCR-stimulering (2), og balansen mellom disse ulike signalveiene bestemmer det funksjonelle resultatet. Vi viser at Gαq er involvert i denne reguleringen ved direkte interaksjon med Lck. Interaksjon mellom Gαq og Lck viser hvordan ulike klasser av proteiner kan interagere og åpner for nye muligheter i forståelsen av de molekylære mekanismene som ligger bak aktivering av T-cellen. Hvordan Gαq regulerer aktiviteten til Lck er foreløpig ukjent, men våre data tyder på at Gαq holder Lck i en pre-aktivert tilstand.
De siste års forskning har vist at den «klassiske» lineære signalveien fra TCR til aktivering av T-cellen er en for enkel modell. Det store antallet proteiner en finner i en T-celle, hvor mange har hittil ukjente roller, åpner for en mer kompleks modell hvor kryssregulering mellom ulike signalveier og proteinklasser styrer T-cellens endelige skjebne. Et komplekst signalsystem, liknende det en finner i en dataprosessor, er nok en mer realistisk modell enn en lineær signalkaskade.
KONKLUSJON
Det heterotrimeriske G-proteinet Gαq kan regulere aktiviteten til kinasen Lck. Tidligere har Gαq vært knyttet til andre signalveier enn den fra TCR. Gαq representerer en ny molekylær mekanisme for hvordan Lck kan bli aktivert etter TCR-stimulering. Interaksjonen mellom Gαq og Lck viser også potensialet for kryssregulering mellom ulike signalveier og hvordan aktivering av T-cellen via TCR kan finjusteres. En forståelse for hvordan signalsystemet fungerer i T-cellen vil være essensielt for å kartlegge årsakene bak patogene tilstander som ved hiv/aids, autoimmune sykdommer og visse kreftformer.
Referanser
- Ngai J, Methi T, Andressen KW et al. The heterotrimeric G protein α subunit Gαq regulates T cell receptor mediated immune responses through an Lck-dependent pathway. European Journal of Immunology 2008, 38:3208–18.
- Methi T, Ngai J, Mahic M et al. Short-interfering RNA-mediated Lck knockdown results in augmented downstream T cell responses. Journal of Immunology 2005, 175:7398–7406
(Publisert i NFT nr. 10/2009 side16–17.)
