B7-H3 et viktig protein i utviklingen av kreft
Doktoravhandling
Tittel
The role of the B7-H3 protein in cancer metastasis and resistance to chemotherapy
ISBN: 978-82-8264-307-8
Emne
Tumorbiologi
Stipendiat
Christina Tekle, Institutt for kreftforsk- ning, Radiumhospitalet, Oslo universitetssykehus og Det medisinske fakultet, Universitetet i Oslo
christina.tekle@rr-research.no
Veiledere
Professor Øystein Fodstad og professor Gunhild M. Mælandsmo, Institutt for kreftforskning, Radiumhospitalet, Oslo universitetssykehus
Forsvar av oppgaven
2011, høst
Hovedbudskap
Vi har vist at B7-H3 er et protein som er viktig for kreftcellenes evne til å spre seg og til å motstå cellegiftbehandling.
Ved å hemme ekspresjonen av B7-H3-proteinet motvirkes disse egenskapene.
Dette kan bli et nytt mulig angrepspunkt for behandling av kreftpasienter i fremtiden.
Christina Tekle
Institutt for kreftforskning, Radiumhospitalet, Oslo universitetssykehus og Det medisinske fakultet, Universitetet i Oslo (UiO)
E-post: christina.tekle@rr-research.no
BAKGRUNN OG HENSIKT
Så mange som 90 % av alle kreftpasienter dør på grunn av at kreften har spredd seg til andre organer enn der den opprinnelig oppstod. Denne prosessen kalles metastase. I tillegg er metastasene/dattersvulstene mer resistene mot systemisk terapi enn modersvulsten. For å påvise kreftspredning tidlig og kunne behandle pasientene best mulig, må man ha kunnskap om spredningsprosessen og resistensutvikling, og om de molekyler som er involvert. Et ledd i dette arbeidet er å detektere og karakterisere tumorceller som har spredd seg, men som ikke kan påvises ved vanlige diagnostiske metoder, såkalte mikrometastaser. Denne doktorgraden har sitt utspring i mikrometastaseforskning ved Tumorbiologisk avdeling ved Radiumhospitalet under ledelse av professor Fodstad, der man har brukt antistoffer koblet til paramagnetiske kuler for å trekke ut mikrometastatiske celler fra blod, benmarg og lymfeknuter ved hjelp av en magnet (1). Det monoklonale antistoffet 376.96 har blitt brukt mye i denne sammenheng og er spesielt nyttig da det bindes til tumorceller fra de fleste kreftformer og i svært liten grad til normalceller. Vi har påvist at det humane proteinet B7-H3 er det tumor-assosierte antigenet som 376.96 bindes til, og analyser av en rekke kreftcellelinjer viste at B7-H3 var høyt uttrykt på celleoverflaten (2).
B7-H3 er et overflatemolekyl kjent for å ha immunregulatoriske egenskaper. Proteinet tilhører B7-familien som består av totalt sju immunregulatoriske ligander som har stimulerende og/eller inhibitoriske signaler ved T-celleaktivering. Reseptoren for B7-H3 er fremdeles ukjent, men eksperimentelle forsøk har demonstrert at proteinet har både immunstimulerende og hemmende effekter/funksjoner (3).
Ved flere kreftformer har man sett at det er en sammenheng mellom høyt uttrykk av B7-H3 og avansert sykdom og dårlig prognose, og dette har blitt tilskrevet den immunregulatoriske funksjonen til B7-H3 (4). Med tanke på at proteinet er høyt uttrykt på overflaten av ulike typer kreftformer, var hensikten med avhandlingen å studere om B7-H3 har en mer direkte rolle i kreftceller, uavhengig av den kjente immunologiske funksjonen, og spesielt ville vi se om proteinet er involvert i metastase og resistens mot cytostatika, to vesentlige prosesser i kreftbiologi.
MATERIALE OG METODER
Hovedmetoder i de tre forskningsarbeidene: Humane kreftcellekulturer, dyreforsøk og molekylære, biokjemiske- og cellebiologiske assays. Immunohistokjemi ble brukt for å se på uttrykket av B7-H3-proteinet i et begrenset antall pasientprøver for å undersøke relevansen av å studere B7-H3 i en klinisk sammenheng. Cellelinjer etablert fra pasienter med brystkreft og melanom ble studert på molekylært og funksjonelt nivå. For å nærmere forstå funksjonen til B7-H3 manipulerte vi disse cellene slik at de ikke lenger uttrykte proteinet, noe som ble gjort ved å introdusere en short hairpin RNA (shRNA) sekvens som binder seg til B7-H3 og hindrer ekspresjonen. Dette tillot oss å sammenlikne fenotypiske trekk hos celler som hadde uttrykk av B7-H3 med celler som manglet dette proteinet, inklusive effekten av kjemoterapi og cellenes invasjons- og migrasjonsevne. For å belyse de underliggende mekanismer for B7-H3s effekter ble det gjort flere molekylære studier av kreftcellene på gen- og proteinnivå for å identifisere involverte molekyler og signalveier. Videre ble cellevariantene injisert i immundefekte mus for å undersøke terapirespons samt studere cellenes metastase-potensial.
RESULTATER
Ved å midlertidig hemme uttrykket av B7-H3-proteinet i melanom og brystkreft-cellelinjer, så vi en sterk nedgang i cellenes evne til å migrere og invadere gjennom matrigel. Begge disse parametrene er indirekte mål på cellenes metastase-assosierte egenskaper og våre resultater viser dermed at lavt uttrykk av B7-H3 kan føre til redusert metastaseutvikling. For å følge opp disse resultatene, ville vi også inkludere en in vivo-eksperimentell metastasemodell i immundefekte mus og rotter.
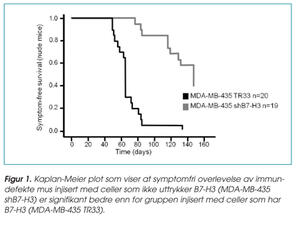
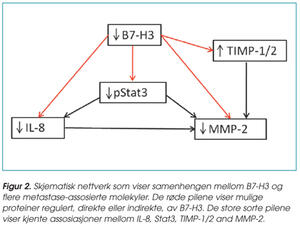
Stabil hemming av B7-H3-uttrykk resulterte i nedsatt metastatisk kapasitet og signifikant økning i symptomfri overlevelse av dyrene, se figur 1. Parallelt var det også en mindre andel av mus i gruppen med nedregulert B7-H3 som hadde mikroskopisk detekterbare metastaser sammenliknet med kontrollgruppen. I tillegg var uttrykket av flere metastase-assosierte proteiner funnet å være regulert av B7-H3, se figur 2. Celler med lavt B7-H3-uttrykk viste redusert sekresjon av interleukin-8 (IL-8), redusert ekspresjon av metalloproteinase-2 (MMP-2) og redusert fosforylering av transkripsjonsfaktoren Stat3, som ofte har forhøyet nivå ved kreft. Moduleringen av disse molekylene kan forklare den minskede metastatiske aktiviteten i disse cellene.
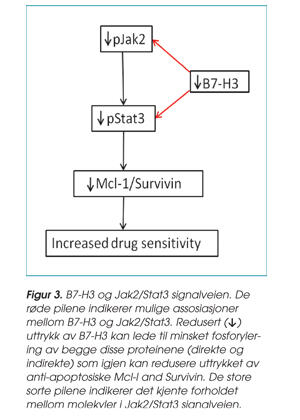
Siden metastase er nært knyttet til kjemoresistens, fokuserte vi våre videre studier på den mulige funksjonen til B7-H3 i respons av metastatiske brystkreftceller på paclitaxel, et kjemoterapeutikum ofte brukt ved brystkreft. Stabil hemming av B7-H3-uttrykk førte til økt paclitaxel-sensitivitet, mens overuttrykk av proteinet i de samme cellene gjorde dem mer resistente. Den sensitiviserende effekten var assosiert med økt paclitaxel-indusert apoptose (programmert celledød). For å forstå mer av de molekylære mekanismene bak, bestemte vi oss for å undersøke Jak2/Stat3 signalveien som nettopp er kjent for å være involvert i kjemoresistens ved brystkreft, og vi fant at aktiviteten eller nivået av fosforylering av Stat3 var redusert i kreftcellene der B7-H3-uttrykket var slått ned. Samtidig så vi at uttrykket av de anti-apoptotiske molekylene Mcl-1 og Survivin var minsket i disse cellene, noe som gjør at cellene i større grad kan undergå apoptose, se figur 3. Videre viste eksperimenter i immundefekte mus at behandling med paclitaxel førte til signifikant anti-tumoreffekt i mus med svulster som ikke uttrykte B7-H3 sammenliknet med kun en marginal effekt i vektor kontrollgruppen. Samlet viser våre data at uttrykket av B7-H3 er av relevans ved brystkreft og at proteinet kan være involvert i paclitaxel-resistens via regulering av Jak2/Stat3 signalveien.
DISKUSJON
For å kunne designe ny og mer effektiv behandling av kreft, må man ha innsikt i underliggende mekanismer for metastasering og kjemoresistens. Forskningen i denne avhandlingen viser en ny funksjon av B7-H3 som kan få betydning for kreftpasienter. De fleste studier der uttrykket av B7-H3 har blitt vurdert ved hjelp av immunohistokjemi i materiale fra kreftpasienter, konkluderer at høyt B7-H3-uttrykk er assosiert med avansert sykdom og/eller dårlig prognose og at disse negative effektene kan relaterestil en immunhemmende effekt av proteinet. Vi har imidlertid, i systemer med lite eller ingen immunologiske faktorer til stede, observert at B7-H3 er involvert i to essensielle maligne prosesser hos tumorcellene, nemlig metastase og kjemoresistens.
Våre funn viser en ny funksjon av B7-H3 i tillegg til dets kjente immunregulatoriske egenskaper og at hemming av proteinet gir en fenotype som er mindre metastatisk og mer sensitiv for kjemoterapi. Dette indikerer at målrettet terapi mot B7-H3 kan være en aktuell strategi, og i denne sammenhengen har vi identifisert flere molekyler og signalveier som er påvirket av B7-H3-proteinet. Et svært aktuelt tema i moderne kreftterapi er utviklingen av småmolekylære forbindelser som kan hemme signalveier som er dysregulert ved kreft, og et fremtidig håp er at det kan bli mulig å inhibere uttrykket av B7-H3 med slike hemmere.
KONKLUSJON
B7-H3 er et immunregulatorisk protein, kjent for å ha både stimulatorisk og inhibitorisk effekt på aktiveringen av T-celler. Vi har kartlagt en ny funksjon av dette proteinet som ikke er relatert til dets rolle i immunregulering, og vi har vist at proteinet er høyt uttrykt ved ulike kreftformer, noe som er assosiert med økt metastastisk potensiale og utvikling av resistens mot kjemoterapi. Således kan inhibisjon av B7-H3-uttrykk være er en lovende strategi for å hemme metastasering, som er årsaken til de fleste kreftrelaterte dødsfall, og også å øke effekten av konvensjonell kjemoterapeutisk behandling.
Referanser
- Flatmark K, Bjornland K, Johannessen HO et al. Immunomagnetic detection of micrometastatic cells in bone marrow of colorectal cancer patients. Clin Cancer Res 2002; 8: 444–9.
- Chen YW, Tekle C, Fodstad O. The immunoregulatory protein human B7H3 is a tumor-associated antigen that regulates tumor cell migration and invasion. Current cancer drug targets 2008; 8: 404–13.
- Nygren MK, Tekle C, Ingebrigtsen VA et al. B7-H3 and its relevance in cancer; immunological and non-immunological perspectives. Frontiers in bioscience (Elite edition) 2011; 3: 989–93.
- Loos M, Hedderich DM, Friess H et al. B7-h3 and its role in antitumor immunity. Clinical & developmental immunology 2010; 2010: 683875.
(Publisert i NFT nr. 2/2012 side 28–29.)
