Individuell immunmodulering: Mykofenolat og IMP dehydrogenase

Individuell immunmodulering
Prosjektet «Individuell immunmodulering» bygger på et nært samarbeid med Pål-Dag Line ved Kirurgisk avdeling samt Anders Hartmann og Karsten Midtvedt ved Medisinsk avdeling, Rikshospitalet-Radiumhospitalet HF. Gjennomføringen av studiene er tilrådd av Regional komité for medisinsk forskningsetikk.
Tekst: Nils Tore Vethe, cand.pharm., Sara Bremer, cand.pharm., Helge Rootwelt, dr.med. og Stein Bergan, dr.philos., Avdeling for medisinsk biokjemi, Rikshospitalet-Radiumhospitalet HF
I 1896 ble det gitt ut en italiensk publikasjon hvor Bartolomeo Gosio skrev at han hadde isolert en substans fra bedervet mais. Denne substansen som var en metabolitt fra en Penicillium-kultur, fikk senere navnet mykofenolat og viste seg å kunne bremse celledeling. Forskere hadde håp om at substansen kunne brukes som antibiotikum eller kreftmedisin. På 1960-tallet ble det avdekket at mykofenolat hemmet enzymet inosinmonofosfat dehydrogenase (IMPDH) (1). Dette er et sentralt enzym i syntesen av guanin- og deoksyguaninnukleotider; byggesteiner for henholdsvis RNA og DNA (se figur 1). IMPDH uttrykkes som to isoenzymer med tilsvarende katalytisk aktivitet (2). Det ble oppdaget at lymfocytter er svært sensitive for IMPDH-hemming, og mykofenolat ble utprøvd som et immundempende medikament. I 1995, om lag hundre år etter at substansen først ble isolert, ble mykofenolat tatt i bruk som prodrug-esteren mykofenolatmofetil ved rejeksjonsprofylakse hos transplanterte. I dag inngår mykofenolat i kombinasjon med kalsineurinhemmere (takrolimus eller ciklosporin) og steroider i de fleste behandlingsprotokoller mot transplantatavstøtning.
Mykofenolats farmakokinetikk utviser stor grad av variasjon mellom individer (3,4). Til tross for dette er medikamentet godkjent med fast dosering (hos nyretransplanterte 1 gram mykofenolatmofetil / 720 mg mykofenolatnatrium x 2). Det er dokumentert at arealet under kurven for plasmakonsentrasjon vs. tid innenfor doseintervallet (AUC; dvs. total eksponering) er relatert til klinisk effekt (5), men det har vist seg å være ressurskrevende og til dels vanskelig å individualisere doseringen etter AUC-målinger.
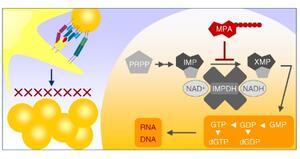
Figur 1. Mykofenolat (MPA) virker immundempende ved å hemme inosinmonofosfat dehydrogenase (IMPDH). Lymfocytter som gjenkjenner antigen fra transplantatet, aktiveres og stimuleres til å ekspandere i antall. De aktiverte lymfocyttenes proliferasjon bremses på grunn av at mykofenolat reduserer cellenes kapasitet for syntese av ribonukleinsyre (RNA) og deoksyribonukleinsyre (DNA). PRPP, fosforibosyl pyrofosfat; IMP, inosin 5'-monofosfat; XMP, xantosin 5'-monofosfat; NAD, nikotinamid-adenin-dinukleotid; (d)GNP, (deoksy)guaninnukleosid mono-/di-/tri-fosfater.
Individuell Immunmodulering
Forskningsprosjektet «Individuell immunmodulering» ledes av cand.pharm./dr.philos. Stein Bergan ved Avdeling for medisinsk biokjemi, Rikshospitalet-Radiumhospitalet HF. Hovedmålet er å utvikle metoder for å individualisere den immundempende behandlingen etter transplantasjon slik at avstøtning og bivirkninger opptrer i minst mulig grad. Mykofenolats farmakokinetikk, farmakodynamikk og farmakogenetikk er spesielt i fokus.
Bakgrunn for IMPDH-studier
Mykofenolat er en reversibel inhibitor av IMPDH. Den umiddelbare virkning kan dermed observeres som redusert IMPDH-aktivitet. Et spørsmål som bør besvares, er hvorvidt terapeutisk bruk av mykofenolat også vil påvirke genuttrykket av IMPDH og derved det underliggende nivået av enzymet, og eventuelt om dette kan ha konsekvenser for effekt og sikkerhet. Et interessant aspekt ved IMPDH er at dette enzymet indirekte katalyserer dannelsen av sine egne byggesteiner: guaninnukleotider inkorporeres i RNA som videre translateres til protein.
I en studie som ble gjennomført i 2002–2004 ved Rikshospitalet, ble det i ukene etter nyretransplantasjon observert en gradvis økning av IMPDH-aktiviteten i blodceller fra pasienter som brukte mykofenolat. Aktiviteten økte til ca. fem ganger utgangsnivået (6). Etter detteble det behov for mer detaljerte undersøkelser i spesifikke blodcellepopulasjoner, og nye målemetoder ble utviklet.
I tillegg til mykofenolats intra- og interindividuelle farmakokinetiske variasjon, er det også svært variabel IMPDH-aktivitet (fenotype) mellom individer (7). Sett i sammenheng med at mange pasienter opplever mykofenolat-relaterte bivirkninger som gjerne medfører dosereduksjon eller seponering, er vår hypotese at behandlingen kan bedres ved å individualisere doseringen av mykofenolat basert på pasientens IMPDH-aktivitet. Siden CD4+ T-lymfocytter er sentrale i immunaktiveringen, ble en metode for å måle effekten av mykofenolat (IMPDH-inhibering) i denne celletypen utviklet (8). Både friske personer og transplanterte pasienter inngår i farmakokinetiske-farmakodynamiske studier som vil danne grunnlag for videre undersøkelser av terapeutisk gunstig IMPDH-aktivitet/inhibering.
Genuttrykk av IMPDH 1 og 2 i blodceller
Resultat fra flere studier tyder på at regulering av IMPDH-genuttrykk er en medvirkende mekanisme for endringer i IMPDH-enzymaktivitet. Isoenzymene IMPDH 1 og 2 har høy grad av sekvenshomologi og analyse av IMPDH-enzymaktivitet skiller ikke mellom disse. Genene IMPDH 1 og 2 er lokalisert på forskjellige kromosomer og er underlagt separate mekanismer for regulering som ennå bare er delvis kjent (9). Isoenzymene er assosiert med forskjellige funksjoner, men de relative bidragene i ulike celletyper og situasjoner er i liten grad kartlagt.
For å lære mer om reguleringen av IMPDH-enzymene, spesielt under påvirkning av immundempende legemidler, har vi utviklet og validert en metode for kvantifisering av IMPDH 1 og 2-genuttrykk i blodceller (10). I første omgang var det aktuelt å undersøke hvorvidt den observerte økningen i basal IMPDH-enzymaktivitet de første ukene etter transplantasjon skyldtes regulering på mRNA-nivå, hvilke blodcellepopulasjoner som var involvert og forskjeller mellom isoenzymene. Et sentralt spørsmål er om det skjer en induksjon av IMPDH slik at effekten av mykofenolat motvirkes. Det ble gjennomført en studie med 30 nyretransplanterte pasienter hvor det ble tatt prøver før og i løpet av de to første ukene etter transplantasjon og oppstart med immundempende behandling (mykofenolat/basiliximab; n = 25/5 + kalsineurinhemmer + steroider). Videre var det ønskelig å studere mykofenolats effekt alene på genuttrykket av målenzymene gjennom et doseintervall. I en pågående studie måles IMPDH 1 og 2 mRNA i gjentatte prøver fra friske frivillige i et døgn etter en dose mykofenolatmofetil (0,25–1,0 g). Prøvematerialet er CD4+ celler som er relevante for mykofenolats effekt, samt fullblodceller og retikulocytter (umodne erytrocytter som fortsatt inneholder preformert mRNA).
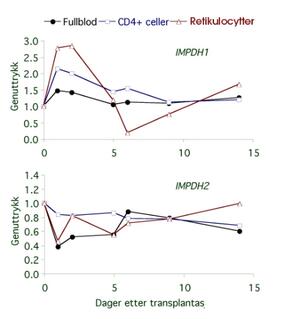
Figur 2. Genuttrykk av IMPDH 1 og 2 i blodceller isolert fra en nyretransplantert pasient. Kurvene illustrerer genuttrykket i fullblod, CD4+ celler og retikulocytter de to første ukene etter transplantasjon og oppstart med immundempende behandling. Verdiene for dag 0 er median av 3 pre-transplantasjonsmålinger og representerer genuttrykket uten påvirkning av immundempende legemidler. Genuttrykket for IMPDH 1 og 2 presenteres relativt i forhold til et snitt av utrykket for tre husholdningsgener.
Studiene viser at både steroider og mykofenolat er faktorer som kan påvirke reguleringen av IMPDH 1 og 2. De to isoformene påvirkesulikt, og reguleringen varierer med forskjellige cellepopulasjoner (se figur 2). Genuttrykket for IMPDH2 i fullblod og retikulocytter tilsvarer endringene i enzymaktivitet som observeres i fullblodceller. Dette tyder på at IMPDH2-enzymaktivtet i erytrocytter spiller en betydelig rolle for den totale enzymaktiviteten målt i fullblod. Siden endringer i IMPDH 1 og 2-genuttrykk medvirker til endringer i enzymaktivitet, vil også effekten av mykofenolat og risiko for avstøtning etter transplantasjon kunne påvirkes. Nivåene av IMPDH 1 og 2-uttrykk varierer mellom individer, og det vil være interessant å undersøke eventuelle sammenhenger mellom nivå av genuttrykk og behandlingsrespons.
Resultatene bidrar til økt kunnskap om effekten av immundempende behandling på IMPDH 1 og 2-genuttrykk i ulike cellepopulasjoner. Dette kan ha klinisk nytte ved etablering av strategier for individuell tilpasning av mykofenolatbehandlingen. Fordi det er flere faktorer som påvirker IMPDH-genuttrykk og -aktivitet, kan måling av enzymaktivitet være bedre egnet som monitoreringsmål enn mykofenolatkonsentrasjonen.
Reguleringen av isoenzymene er nært knyttet til celleproliferasjon og differensiering, og malign proliferasjon er forbundet med oppregulering av IMPDH2 (11). Kunnskap om isoenzymenes spesifikke regulering og funksjoner er viktig for forståelsen av sykdomsmekanismer ved for eksempel kreft og ved utvikling av legemidler med isoenzymspesifikk virkning.
Molekylærfarmakologisk respons i CD4+ celler
De CD4+ cellene isoleres fra blodprøver ved hjelp av paramagnetiske kuler dekket med antistoff mot overflatemarkøren CD4. I en slik isoleringsprosess hvor vasking av cellene er nødvendig, vil mykofenolat også vaskes ut av cellene. Den intracellulære mykofenolatkonsentrasjonen gjenopprettes ved å inkubere de isolerte cellene i plasma fra blodprøven. Dette er viktig for å gjenspeile situasjonen in vivo. Videre måles hastigheten på enzymreaksjonen som IMPDH katalyserer. Reaksjonshastigheten er et mål på hvor mange aktive enzymer som er til stede.
Den molekylærfarmakologiske responsen er tett knyttet til plasmakonsentrasjonen av mykofenolat. En kraftig IMPDH-hemming, ofte 80-90% hemming ved standard dosering, observeres i relasjon til maksimal plasmakonsentrasjon av mykofenolat. Deretter avtar enzymhemmingen parallelt med at mykofenolat skilles ut av kroppen, hovedsakelig som glukuronidert metabolitt i urin.
I figur 3 er det vist en farmakokinetisk-farmakodynamisk profil hvor en frisk person har inntatt 500 mg mykofenolatmofetil (mikstur). Både absorpsjonen og utskillelsen er meget rask. I dette tilfellet observeres maksimal plasmakonsentrasjon av mykofenolat 15 minutter etter doseinntak. Det er verdt å merke seg den sekundære konsentrasjonsøkningen (her etter 8–10 timer) som skyldes enterohepatisk sirkulasjon: I forbindelse med måltid som stimulerer gallesekresjon, skilles mykofenolatglukuronid ut i tarmen via galleveien, bakterielle enzymer spalter av glukuronidet og mykofenolat reabsorberes til blodomløpet. Responskurven viser en betydelig sekundær IMPDH-hemming, noe som gir verdifull kunnskap om medikamentets farmakologi.

Figur 3. Farmakokinetisk og farmakodynamisk profil for mykofenolat etter administrering av 500 mg mykofenolatmofetil (mikstur) til en frisk person. Den molekylærfarmakologiske responsen er i tid tett knyttet til medikamenteksponeringen. Mykofenolat plasmakonsentrasjon og IMPDH-aktivitet i CD4+ celler.
Det vilvære nødvendig å gjennomføre studier i pasientpopulasjoner for å komme frem til hvilken IMPDH-aktivitet (inhiberingsgrad) som gir gunstig behandlingseffekt og akseptabel bivirkningsprofil. I denne sammenheng vil det også være viktig å forenkle metodologien slik at den tilpasses akseptabel ressursbruk. Et minimum av målepunkter bør tilstrebes, og den eventuelle gevinst av å predikere responsforløpet ved hjelp av farmakodynamiske modeller bør undersøkes.
Oppsummering
Den immundempende behandling av transplanterte pasienter balanserer mellom risiko for avstøtning og risiko for alvorlige bivirkninger. Økt kunnskap om mykofenolats farmakogenetikk og farmakokinetikk-farmakodynamikk kan bidra til utviklingen av bedre behandlingsprinsipper. Dosering av mykofenolat basert på individuelt nivå av målenzymet IMPDH kan være en mulighet for å oppnå bedre behandlingsresultater.
Referanser
- Franklin TJ, Cook JM. The inhibition of nucleic acid synthesis by mycophenolic acid. Biochem J. 1969;113:515–524.
- Carr SF, Papp E, Wu JC, et al. Characterization of human type I and type II IMP dehydrogenases. J Biol Chem. 1993;268:27286–27290.
- Shaw LM, Holt DW, Oellerich M, et al. Current issues in therapeutic drug monitoring of mycophenolic acid: report of a roundtable discussion. Ther Drug Monit. 2001;23:305–315.
- van Gelder T, Meur YL, Shaw LM, et al. Therapeutic Drug Monitoring of Mycophenolate Mofetil in Transplantation. Ther Drug Monit. 2006;28:145–154.
- van Gelder T, Hilbrands LB, Vanrenterghem Y, et al. A randomized double-blind, multicenter plasma concentration controlled study of the safety and efficacy of oral mycophenolate mofetil for the prevention of acute rejection after kidney transplantation. Transplantation. 1999;68:261–266.
- Vethe NT, Mandla R, Line PD, et al. Inosine monophosphate dehydrogenase activity in renal allograft recipients during mycophenolate treatment. Scand J Clin Lab Invest. 2006;66:31–44.
- Glander P, Hambach P, Braun KP, et al. Pre-transplant inosine monophosphate dehydrogenase activity is associated with clinical outcome after renal transplantation. Am J Transplant. 2004;4:2045–2051.
- Vethe NT, Bergan S. Determination of Inosine Monophosphate Dehydrogenase Activity in Human CD4+ Cells Isolated from Whole Blood During Mycophenolic Acid Therapy. Ther Drug Monit. 2006;28:608–613.
- Natsumeda Y, Ohno S, Kawasaki H, et al. Two distinct cDNAs for human IMP dehydrogenase. J Biol Chem. 1990;265:5292–5295.
- Bremer S, Rootwelt H, Bergan S. Real-Time PCR Determination of IMPDH 1 og 2 Expression in Blood Cells. [Submitted]. 2006.
- Zimmermann AG, Spychala J, Mitchell BS. Characterization of the human inosine-5'-monophosphate dehydrogenase type II gene. J Biol Chem. 1995;270:6808–6814.
(Publisert i NFT nr. 1/2007 side 28–30.)
