Levering av legemidler til øyet

Tekst: Marianne Hiorth, førsteamanuensis, Avdeling for farmasi, Farmasøytisk institutt, UiO
Det vanligste ved behandling av ulike sykdommer i øyet er at legemiddelet administreres rett i selve øyet. Sykdomstilstander som kan oppstå i øyet kan være infeksjoner, glaukom eller tørre øyne. Legemidlene kan injiseres inn i øyet (1), men det vanligste og det de fleste forbinder med levering av legemidler til øyet er topikal administrasjon i form av dråper eller salver.
Å levere legemidler til øyet kan virke enkelt, men øyets spesielle struktur gjør at mange typer øyedråper må administreres ofte, gjerne 4–6 ganger i døgnet. Dette er lite gunstig for pasienten og det påvirker gjerne pasientens compliance. For å forstå de utfordringene man møter ved levering av legemidler til øyet er det nødvendig å vite noe om hvordan øyet er bygget opp.
Øyets oppbygning/struktur
Veggene i øyeeplet består ytterst av den sterke senehinnen hvor vi finner øyemusklene. Innenfor senehinnen finner vi årehinnen med blodårer og helt innerst finner vi netthinnen. Forrest går senehinnen over i hornhinnen (cornea) (figur 1) (2). Hornhinnen har en svært viktig funksjon og det er å beskytte øyet for fremmedlegemer og kjemisk påvirkning.
Hornhinnen har en tredelt struktur som gjør gjennomtrenging av stoffer svært vanskelig. Ytterst ligger et lipofilt epitellag, i midten et hydrofilt lag og innerst finner vi stroma som også er lipofilt. Hornhinnen er kledd med en tynn hinne som kalles konjunktiva. Foran linsen er det et lite kammer som er fylt med kammervæske. Bak linsen finnes det geléaktige glasslegemet. Når blodplasma filtreres gjennom veggen til små blodkar i ciliarlegemet dannes kammervæske. Et lite konstant trykk i øyet blir opprettholdt ved at det er en balanse mellom produksjon og drenasje av kammervæsken. Dersom produksjonen av kammervæske av en eller annen grunn blir for stor, øker tykket og det oppstår en sykdomstilstand kalt glaukom. Glaukom kan i verste fall føre til tap av synet.
Formuleringstyper
Den aller vanligste legemiddelformen for administrasjon av legemidler til øyet er løsninger. De fleste legemidlene som finnes på markedet for topikal administrasjon til øyet er formulert som løsninger (3). De aller fleste er oppløsninger, men det finnes også noen suspensjoner, geler og salver. Det er ulike problemer knyttet til blant annet geler og salver. Det vanligste problemet er at de klissete og at de kan føles ubehagelig på øyet. I tillegg kan de av og til gi synsforstyrrelse i form av tåkesyn (4).
Siden de fleste preparatene som finnes på markedet er oppløsninger, tyder dette på at det er mange fordeler forbundet med denne formuleringsformen. Oppløsninger er svært enkle å lage. I tillegg er de som regel enkle å både filtrere og sterilisere. Dessuten er prisen lav og ofte ønsker pasienten denne administrasjonsformen, dog uavhengig av om det er oppløsninger eller suspensjoner.
Utfordringer knyttet til løsninger som administrasjonsform
Den store ulempen ved bruk av løsninger er at mengden av den administrerte dosen som blir værende i selve øyet er svært liten (5). Når det gjelder levering av legemidler til øyet sier man at biotilgjengeligheten er lav på tross av at mye av dosen kan gjenfinnes i kroppen (men ikke der det er ønskelig).
Biotilgjengeligheten er kun på 1-10 prosent av den administrerte dosen (6). Dette fører tilat pasienten må dryppe ofte og det oppstår en rask stigning av konsentrasjonen av legemiddelet i øyet som hurtig forsvinner igjen. En økning i antall doseringer fremmer sannsynligheten for non-compliance, hvilket ikke er ønskelig. En høyere dosering vil kunne hjelpe noe på biotilgjengeligheten men problemet med økt dose er at det blir flere systemiske bivirkningene hvilket ikke er ønskelig.
Lav biotilgjengelighet
Det største problemet knyttet til levering av løsninger til øyet er altså den lave biotilgjengeligheten. Det er mange årsaker til at biotilgjengeligheten ved administrasjon av legemidler til øyet er lav. For det første er hornhinnen bygget opp for å beskytte øyet mot fremmedlegemer og fremmede stoffer. Den spesielle tredelte strukturen gjør gjennomtrenging av legemidler svært vanskelig (figur 2) (7). Hornhinnen har som tidligere nevnt både lipofile og hydrofile lag, hvilket betyr at legemiddelet bør ha både hydrofile og lipofile egenskaper for å kunne passere. I tillegg til hornhinnens dårlige penetrerbarhet er det også en rekke precorneale faktorer som til sammen gir svært dårlig biotilgjengelighet. Legemiddelet kan både metaboliseres og interagere med proteiner. I tillegg kan legemiddelet absorberes over konjunktiva i stedet for å absorberes over hornhinnen og dette gir ikke ønsket effekt (5).
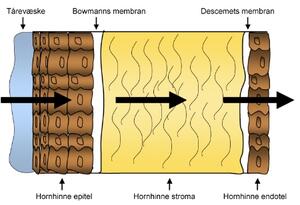
Figur 2. Den tredelte strukturen til hornhinnen bestående av epitel, stroma og endotel gjør det vanskelig for legemidler å passere denne hinnen.
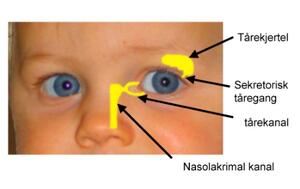
Figur 3. En øyedråpe som innstilles på øyet vil raskt fortynnes på grunn av produksjonen av tårevæske og dreneringen via det nasolakrimale systemet.
I tillegg til hornhinnens struktur er drenasje og sirkulasjon av tårevæske noe av det som gjør det vanskelig å levere legemidler til øyet (figur 3) (5). Tårevæsken på øyet utgjør om lag 7 µl. Den er en isoton løsning av bikarbonat og natriumklorid og pH er tilnærmet lik 7.4. Tårevæsken dreneres hele tiden ned mot nesen. Dersom væskemengden i øyet overstiger 7–10 µl vil det overskytende dreneres bort via det nasolakrimale systemet. I en øyedråpe er det som regel mellom 50 og 100 µl væske. Idet dråpen settes på øyet vil over halvparten forsvinne umiddelbart gjennom dette dreneringssystemet. Tårevæsken som dannes kontinuerlig vil også være med på å hele tiden fortynne dosen av legemiddel som befinner seg på øyet. Dersom det finnes irriterende stoffer i øyedråpen vil drenasjen økes ytterligere. Jo større volum som innstilles, desto mer forsvinner via drenasje. I praksis vil det si at et svært lite volum er ønskelig, men det begrenser seg selv da det er vanskelig både å designe og produsere. I tillegg kan det være et problem at de fleste pasienter ikke vil være i stand til å påføre et så lite volum.
Hvordan kan biotilgjengeligheten økes?
Målet ved formulering av legemidler til øyet er å prøve åøke biotilgjengeligheten. Det er to mulige innfalsvinkler til hvordan biotilgjengeligheten kan økes (8). Tiden formuleringen blir værende i precornea kan økes, eller den transcorneale passasjen kan økes. Det kan være en god tilnærming til problemet å fremme den transcorneale passasjen, men mange av de stoffene som kan benyttes til dette har toksisk effekt på øyet. I denne artikkelen blir det derfor fokusert på hvordan biotilgjengeligheten kan bedres ved å øke tiden formuleringen blir værende i øyet. Det enkleste man kan gjøre for å øke residenstiden i precornea er å sette til polymerer til formuleringen. Mange av formuleringene/oppløsningene som er beregnet til administrasjon på øyet inneholder polymerer.
Polymerer
Polymerer er stoffer med molekylvekt over ca. 10 000 og de kalles ofte makromolekyler (9). De er bygget opp av en rekke mindre enheter eller monomerer (figur 4). Polymerer kan dannes fra levende organismer for eksempel proteiner, nukleinsyrer og polysakkarider. Polymerer representerer et stort utvalg med tanke på fysikalsk-kjemiske egenskaper (10).
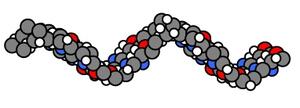
Figur 4. En polymer er bygget opp av en rekke mindre enheter (monomerer) som til sammen danner en lang kjede.
Egenskapene til en polymer er blant annet avhengig av molekylvekten. Noen av de mest interessante egenskapene til en polymer er dens evne til å kunne danne geler og også dens evne til å reagere på ulike stimuli som for eksempel temperatur og pH (11). Det er mange faktorer som må tas hensyn til hvis en polymer skal settes til en formulering som skal appliseres i øyet. Dette er faktorer som pKa, pH i løsningen og toksisitet. I tillegg er det viktig å huske på at øyedråper skal være sterile (12).
Effekten som kan oppnås på formuleringen ved tilsats av polymerer er blant annet å øke viskositeten til løsningen. Viskositet er et uttrykk for løsningens seighet eller motstand mot flyt. Økt viskositet vil gi en nedgang i drenasjen vekk fra hornhinnen. I tillegg vil polymeren kunne feste seg til mucus som finnes i øyet og dette vil føre til at formuleringen bli værende lenger i øyet. Dette kalles for mucoadhesjon. Til slutt kan resten av de ulike formuleringene puttes i en samlesekk. I disse formuleringene er det verken prøvd å øke viskositeten eller å oppnå mucoadhesivitet. I stedet er det forsøkt å oppnå en økt biotilgjengelighet ved at formuleringen blir liggende i konjunktival-sekken over en lengre periode. Dette kan eksemplifiseres ved hjelp av inserter eller lameller. Dette er kontaktlinseliknende formuleringer som legges i øyet og som blir værende der enten til man tar de ut igjen eller til de degraderes.
Viskositetsøkning
Ulike faktorer kan påvirke en polymers evne til å øke viskositeten til en løsning. Først og fremst er interaksjonen mellom polymer og løsemiddel av stor betydning (figur 5). I et godt løsemiddel er interaksjonen mellom polymer og løsemiddel favorisert (10). Da vil polymerkjedene kveile seg ut og få en utstrakt konformasjon. Siden ingen segmenter kan være på samme sted samtidig vil man få en ytterligere utstrekning. Dette kalles excluded volume-effekten. En utstrakt kjede vil ha gode muligheter til å danne interaksjoner med de andrekjedene. Dersom en interaksjon mellom polymer og løsemiddel ikke er favoriserbar, det vil si at polymerkjedene heller vil reagere med seg selv enn med løsemiddelet, vil polymeren krympe. I verste fall krøller polymerkjedene seg sammen til små nøster. Det kan oppstå en kollaps av hele nettverket med påfølgende faseseparasjon (11). Dette fører til at viskositeten til løsningen synker dramatisk. Effekten av løsemiddelet kan påvirkes av andre tilsetningsstoffer og pH vil også være av betydning. I en kjede som er ionisert vil kjedesegmentene frastøte hverandre og dermed får polymeren en mer utstrakt konformasjon.
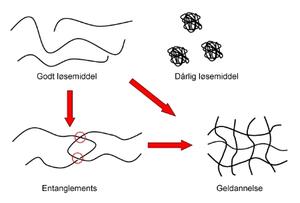
Figur 5. I et godt løsemiddel vil polymeren kveile seg ut og kjedene vil kunne danne interaksjoner med andre kjeder og til slutt vil det kunne dannes en gel. Entanglements er indikert med røde sirkler. Dersom polymeren er i et dårlig løsemiddel vil den krølle seg sammen og interaksjoner med andre kjeder blir vanskeligere.
Viskositeten til en løsning kan bestemmes ved hjelp av grenseviskositeten (intrinsic viscosity) (9). Dersom grenseviskositeten finnes kan man også undersøke om løsemiddelet er godt eller dårlig. Dersom det er et godt løsemiddel vil viskositetsøkningen være avhengig av blant annet molekylvekten til polymeren. Jo høyere molekylvekt, desto mer viskøs vil løsningen være. Det vil også være en sammenheng mellom konsentrasjonen av polymer og viskositeten som blir høyere når konsentrasjonen økes. Konformasjon på kjeden spiller også inn. En lineær kjede har høyere viskositet enn en forgrenet kjede.
Det finnes ulike tilnærminger for hvordan en viskositetsøkning kan utføres. En mulighet er å tilsette polymeren ved tillaging av preparatet. Viskositetsøkningen skjer der og da og er stabil gjennom hele holdbarhetstiden til prepratet. Mange av øyedråpene som finnes tilgjengelig på markedet er tilsatt polymerer for å øke viskositeten til preparatet. Idet dråpen appliseres vil formuleringen ha samme viskositet på øyet som i øyedråpeflasken. Etter hvert vil viskositeten på formuleringen minke, fordi blant annet tårevæsken fortynner systemet. Det er viktig at viskositeten ikke er så høy at det blir problematisk å få løsningen ut av beholderen, og doseringen må ikke påvirkes. En annen tilnærming er at løsningen har lav viskositet i beholderen og at det skjer en geldannelse in-situ (på stedet) når løsningen appliseres i øyet. Geldannelsen kan trigges av pH, temperatur eller ulike ioner som finnes i tårevæsken. Denne effekten er begrenset av at tårevæsken hele tiden vil kunne fortynne formuleringen.
Et eksempel på en oppløsning som danner gel in-situ finner vi i systemet Gelrite® (13). Denne formuleringen blir i dag benyttet til administrasjon av timolol som er en ikke selektiv betablokker. Timolol brukes ved behandling av glaukom. Øyedråpene, som er et depotpreparat, kan administreres kun én gang om dagen hvilket er en stor fordel. Polymeren som inngår i dette systemet er gellan gum. Gellan gum er et heteropolysakkarid bygget opp av en ryggrad bestående av glukose, glukuronsyre og rhamnose. Gelrite® danner gelved tilsats av kationer som for eksempel natrium, kalium og kalsium. Flere ulike modeller har blitt foreslått for mekanismen for geldannelse. Robinson et al. har kommet frem til at ved romtemperatur, dersom ioner er fraværende, danner gellan gum doble helikser (14) (figur 6).
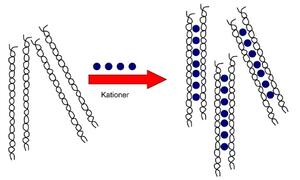
Figur 6. I romtemperatur vil gellan gum danne løse assosiasjoner av doble helikser. Dersom kationer tilsettes systemet vil heliksene bindes sammen. Hvis konsentrasjonen er høy nok, vil det kunne dannes en gel.
Denne løsningen har lav viskositet og det er kun svake interaksjoner mellom heliksene (van der Waalske). Dersom kationer tilsettes vil kationene assosieres til heliksene og det kan bli dannet et nettverk. De kation medierte aggregatene kryssbinder gelen dersom konsentrasjonen av både kation og polymer er høy nok. Siden tårevæsken inneholder blant annet natrium-, kalsium- og kaliumioner vil gellan gum danne en gel når den appliseres på øyet (15). Geldannelse av Gelrite® skjer i konjunktival-sekken. Drenasje fra precornea vil av den grunn bli lavere enn for et system som ikke danner en gel, men forblir en løsning. Det er en stor fordel at formuleringen tåler autoklavering. I senere tid har det vist seg at gellan gum mest sannsynlig også har mucoadhesive egenskaper og at dette i tillegg til dannelsen av en gel vil være med på å øke den precorneale residenstiden.
Mucoadhesjon
Noen polymerer, som for eksempel gellan gum, har mucoadhesive egenskaper. Formuleringen vil da kunne feste seg til øyet og vi får en forlenget residenstid i precornea. Mucosa er det fuktige vevet som ligger over både organer og kroppshulrom som munn, tarm, nese og deler av øyet. De viktigste bestanddelene av mucosa er glykoproteinet mucin, lipider, vann og elektrolytter.
Det er mange ulike teorier for hvordan mucoadhesjon mellom en formulering og mucin kan skje. For det første må det skje en kontakt mellom formulering/polymer og mucosa (figur 7) (15,16). For løsninger og halvfaste formuleringer vil det si at man må ha fukting og spredning. Deretter må det oppstå en interpenetrering av polymer inn i mucuslaget. Til slutt må det skje en interaksjon mellom polymer og mucin. Dette kan skje ved entanglements, van der Waalske bindinger, elektrostatisk tiltrekning, hydrogenbindinger og hydrofobe interaksjoner. Entanglements oppstår når polymerkjedene tvinner seg i hverandre og det dannes knutepunkter (figur 5).
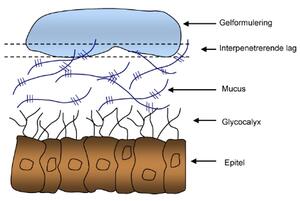
Figur 7. En gel som er mucoadhesiv består blant annet av polymerkjeder, som kan penetrere inn i mucus og danne interaksjoner. Interaksjonen skjer i det interpenetrerende laget.
Mucoadhesiviteten til en polymer påvirkes av flere faktorer blant annet molekylvekt (17). For best mulig mucoadhesjon finnes det en optimal molekylvekt. Kjedene må være så små at det tillates en enkel penetrasjon, men store nok til at entanglements kan skje. I tillegg vil en mer fleksibel kjede ha større evne til å penetrere inn i mucosa enn en stiv kjede. Konsentrasjonen av polymeren påvirker også mucoadhesjonen og ved for høye konsentrasjoner er gjerne kjedene mer kveilet sammen (coils), hvilket gir en lavere fleksibilitet.Ved for lav konsentrasjon er det ikke nok kjeder til at det kan skje en interaksjon. Dersom det er høy grad av kryssbinding er systemet lite fleksibelt og det er mindre sannsynlig at det vil finne sted en mucoadhesjon. Tilstedeværelse av kjemiske grupper, ladning og ionisering påvirker også adhesjonen.
Skreddersydd bærersystem
Det siste alternativet som kan gi en økt residenstid i cornea, går ut på at man skreddersyr et bærersystem som blir værende i konjunktival-sekken. Dette fører til en forlenget frisetting. Det finnes flere ulike typer skreddersydde formuleringssystemer som passer inn under denne betegnelsen. Det kan være nanopartikler (18), mikrosfærer (19), liposomer (8) og inserter (20). Fordelen med små partikler i nano-området er blant annet at partiklene kan formuleres som øyedråper, noe som gjør administrasjonen enkelt (21). Av inserter finnes både bioeroderbare systemer (20) som hydrofile kontaktlinser og collagen shields (22, 23) og det finnes ikke eroderbare inserter som for eksempel Ocusert®.
Et av de systemene som har fungert tilfredsstillende i tillegg til løsninger er Ocusert®. Dette er et ikke eroderbart system som består av en pilokarpin-alginat matrix med et etylvinylacetat permeabelt coatinglag (23, 24). Det er coatinglaget som bestemmer frisettingen. Med dette systemet kan man oppnå en jevn frisetting av pilokarpin over sju dager. Grunnen til at det ikke ble en stor suksess på tross av at det er et godt system formuleringsmessig var blant annet at det var dyrt. I tillegg var det vanskelig for pasienten, som ofte var eldre mennesker, å administrere formuleringen. Nådestøtet kom da pilokarpin ikke lenger var førstevalg ved behandling av glaukom.
Hvor går veien videre?
De fleste formuleringsprinsippene for okulær administrasjon av legemidler baserer seg på kombinasjoner av ulike prinsipper. Det kan være in-situ geling i kombinasjon med en mucoadhesiv polymer, eller liposomer eller mikropartikler coatet med en mucoadhesiv komponent. Det er i tillegg en viss forskning på systemer som baserer seg på myke kontaktlinser og inkorporasjon av virkestoff og/eller bærer i denne (4). Men det kan virke som om både pasienter og leger ønsker dråper som administrasjonsform kontra inserter (kontaktlinser).
Konklusjon
Det er mange hindre som må overvinnes før man kan lage et preparat som er godt egnet for levering av legemidler til øyet. Tilsats av polymerer til formuleringen er et viktig hjelpemiddel for å bedre biotilgjengeligheten. Biotilgjengeligheten bedres ved at formuleringen får en forlenget residenstid i precornea. Dette skyldes økt viskositet og/eller de mucoadhesive egenskapene til polymerene. Eventuelt kan man designe et skreddersydd bærersystem av polymerer.
Referanser
- Einmahl, S. et al. Therapeutic applications of viscous injectable poly(ortho esters). Advanced drug delivery reviews (2001). 53.
- Haug, E, Sand, O, Sjaastad, ØV. Menneskets fysiologi. 1992. Universitetsforlaget. Oslo. Norge.
- www.felleskatalogen.no/. ATC registeret. S Sanseorganer.
- Ali, Y, Lehmussari, K. Industrial perspective in ocular drug delivery. Advanced drug delivery reviews (2006). 58.
- Reddy, IK. Ocular Therapeutics and Drug delivery. A multi-disciplinary approach. 1996. Technomic Publishing Co Inc. Basel. Sveits.
- Davies, NM, Biopharmaceutical considerations in topical ocular drug delivery.Clinical and experimental pharmacology and physiology. (2000). 27.
- Florence, AT, Attwood, D. Physicochemical Principles of Pharmacy. Second Edition. 1988. Macmillan Press LTD. London. UK.
- Kaur, IP, Garg, A, Singla, AK, Aggarwal, D. Vesicular systems in ocular drug delivery: an overwiev. International journal of pharmaceutics. (2004). 269
- Elias, HG. An introduction to Polymer Science. 1997. VCH. New York. USA.
- Grosberg, AY, Khoklov, AR. Giant Molecules. Here there and everywhere. 1997. Academic Press. San Diego. USA
- Hiorth, M. Stimuli-responsive polymerer i farmasøytisk forskning – prinsipper, design og fremtidsaspekter. NFT (2007). 6.
- European Pharmacopoeia online 5th edition 2007 (5.8)
- Rozier, A, Mazuel, C, Grove, J, Plazonnet, B. Gelrite®: A novel, ion-activated, in-situ gelling polymer for ophthalmic vehicles. Effect on bioavailability of timolol. International journal of pharmaceutics (1989), 57.
- Robinson, G, Manning, CE, Morris, ER. 1991. Food polymers, gels and colloids. Dickinson editor. Royal Society Chemistry. London. UK.
- Paulsson, M. Controlled release gel formulations for mucosal drug delivery. Ph.D thesis. 1992. Uppsala. Sverige.
- Ludwig, A. The use of mucoadhesive polymers in ocular drug delivery. Advanced drug delivery reviews (2005). 57.
- Smart, JD, The basics and underlying mechanisms of mucoadhesion. Advanced drug delivery reviews (2005). 57.
- Campos, A. et al. Chitosan nanoparticles as new ocular drug delivery systems: in vitro stability, in vivo fate and cellular toxicity. Pharmaceutical research. (2004). 21.
- Kimura, H, Ogura, Y. Biodegradable polymers for ocular drug delivery. Ophtalmologica. (2001). 215.
- Merkli, A, Tabatabay, C, Gurny, R, Heller, J. Biodegradable polymers for the controlled release of ocular drugs. Progress in polymer science. (1998). 23.
- Vandervoort, J, Ludwig, A. Ocular drug delivery: nanomedicine applications. Nanomedicine (2007). 2.
- Sultana, Y, Aqil, M, Ali, A, Samad, A. Advances in the topical ocular drug delivery. Expert review ophtamology (2007). 2.
- Saettone, MF, Salminen, L. Ocular inserts for topical delivery. Advanced drug delivery reviews (1995). 16.
- Chien, YW. Novel drug delivery systems. Second Edition. 1992. Marcel Dekker Inc. New York. USA.
(Publisert i NFT nr. 10/2007 side 31–35.)
