Elektromembranekstraksjon et helt nytt konsept for ekstraksjon av peptider
Figurer
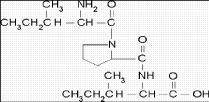
Figur 1. Isoleucine-Proline-Isoleucine (IPI)
![]()
Figur 3. 1-oktanol
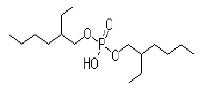
Figur 4. Di-(2-etylhexyl)fosfat (DEHP)
Tekst: Marte Balchen, cand.pharm., stipendiat, Farmasøytisk institutt, Universitetet i Oslo
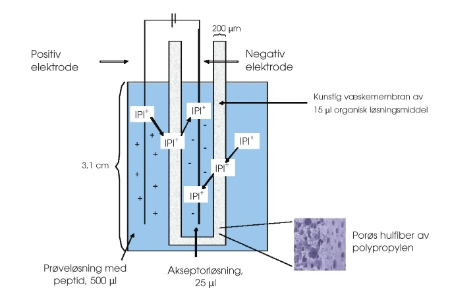
Figur 2. EME av peptider (IPI).
Dersom man som farmasøyt arbeider innen fagfeltet legemiddelanalyse, er analysering av kjemiske og biokjemiske substanser (legemidler) i ulike matrikser en vanlig utfordring. Ofte ønsker man både å identifisere og kvantifisere den aktuelle substansen i en kompleks matriks (for eksempel blod, urin eller spytt), som inneholder flere andre komponenter i tillegg til substansen av interesse. Utfordringene i disse analysene er som regel lav konsentrasjon av substans og lite prøvevolum (en bloddråpe, litt spytt). I tillegg vil en matriks som blod kunne ødelegge instrumentene som benyttes til analyse dersom blodet injiseres direkte inn på instrumentet. I mange tilfeller er det derfor nødvendig med en prøveopparbeidelse i forkant av analysen.
Prøveopparbeidelse
Formålet med prøveopparbeidelsen er å oppkonsentrere substansene man er interessert i, og å isolere dem fra den opprinnelige matriksen. En av de mest brukte teknikkene for prøveopparbeidelse er væske-væske ekstraksjon (LLE). LLE baserer seg på en substans fordeling mellom to ikke-blandbare væsker (vandig/organisk) ved hjelp av passiv diffusjon. De siste ti årene har det vært en økende interesse for miniatyrisering av væske-væske ekstraksjoner, og omfattende forskning har vært rettet mot utviklingen av væskefase-mikroekstraksjon (LPME). Fordeler med LPME er høy oppkonsentrering av kjemiske og biokjemiske substanser (legemidler), lave kostnader, rask og enkel automatisering og redusert bruk av organiske løsningsmidler (1).
I 2005 ble et nytt konsept kalt elektromembranekstraksjon (EME) introdusert ved Universitetet i Oslo (2). Konseptet er en videreutvikling av LPME og baserer seg på elektrokinetisk migrasjon av ladede substanser. I EME dives ekstraksjonsprosessen av elektrisk spenning, noe som resulterer i kortere ekstraksjonstid enn ved LPME som er basert på passiv diffusjon (3). Den elektrokinetiske migrasjonen foregår i et trefase-system der en kunstig væskemembran skiller to stillestående løsninger (prøveløsning og akseptorløsning) fra hverandre. De to siste årene har forskningen på EME vært rettet mot isolering og oppkonsentrering av basiske og sure legemidler. Kunnskapen om parametrer som påvirker ekstraksjonsutbyttet har økt, og en teoretisk beskrivelse av ekstraksjonsprosessen har blitt utviklet (4-6).
Peptider
Kunnskapen om peptidenes viktige rolle i levende organismer har økt de seneste årene. Peptider kan fungere som hormoner, neurotransmittorer, legemidler, antibiotika og som diagnostisk verktøy (biomarkører) ved visse sykdommer. Interessen for å utvikle nye og spesifikke teknikker for å isolere og oppkonsentrere biologisk aktive peptider fra ulike matrikser er derfor voksende. Arbeidet som presenteres her er så vidt vi vet det første som er rapportert om elektromembranekstraksjon av peptider.
Peptider er polymerer av aminosyrer, og byggesteiner i proteiner. Tripeptidet Isoleucine-Proline-Isoleucine (IPI) er illustrert i figur 1. I dette arbeidet ble det forsket på EME av åtte ulike peptider, fordelt på tre angiotensiner, tre neurotensiner og to tri-peptider. Disse peptidene har ulik struktur, med variasjon i antall aminosyrer, aminosyresekvens, antall ioniserbare grupper og polaritet (tabell 1).
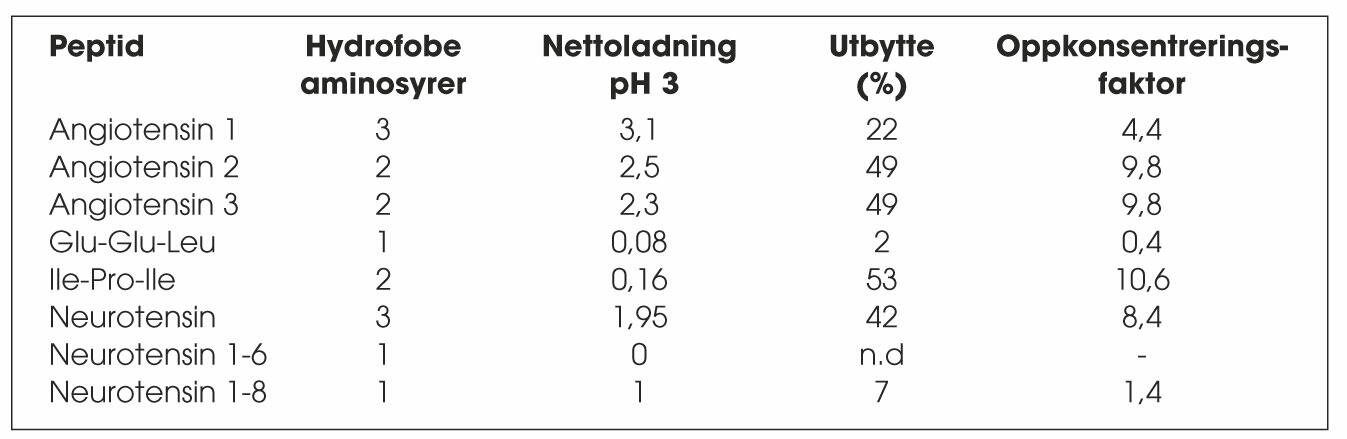
Tabell 1. Ekstraksjonsutbytter etter fem minutter med EME
Elektromembranekstraksjon
Det eksperimentelle oppsettet for ekstraksjon av tripeptidet IPI er vist i figur 2. En vandig løsning med IPI (1 µg/ml) utgjør prøveløsningen på 500 µl. Løsningen er surgjort med HCl slik at peptidet har en positiv nettoladning. En porøs hulfiber av polypropylen benyttes som en kunstig, organisk væskemembran ved at en liten mengde organisk løsningsmiddel immobiliseres i porene i fiberens vegg. Fiberens hulrom huser en vandig akseptorløsning. I likhet med prøveløsningen er akseptorløsningen surgjort med HCl. To platinaelektroder fører spenning gjennom systemet ved at de er koblet til en spenningskilde. Den positive elektroden er plassert i prøveløsningen og den negative elektroden er plassert i akseptorløsningen. Når spenningen (typisk 50 volt) settes på vil det positivt ladde peptidet migrere mot den motsatt ladde elektroden i akseptorløsningen. Etter fem minutter med tilført spenning og risting av systemet (1050 rpm) er ekstraksjonen fullført, og akseptorløsningen kan trekkes ut med en mikrosprøyte og analyseres ved kromatografi eller kapillærelektroforese. I dette oppsettet vil man med et ekstraksjonsutbytte på 100 % få en oppkonsentreringsgrad på 20 fordi IPI ekstraheres fra 500 µl til 25 µl.
En kritisk faktor for et høyt ekstraksjonsutbytte i EME er sammensetningen av den kunstige væskemembranen. Valg av organisk løsningsmiddel kan gi en selektiv ekstraksjon av substanser basert på deres hydrofobisitet, eller basert på om substansen er positivt eller negativt ladd. Vanlige løsningsmidler er 2-nitrofenyloktyleter og 1-oktanol. For å sikre effektiv ekstraksjon av peptider benyttes en blanding av 1-oktanol (figur 3) og di-(2-etylhexyl)fosfat (DEHP). DEHP (figur 4) er en ionpardanner som danner et hydrofobt kompleks med positivt ladde peptider i grenseflaten mellom prøveløsningen og den organiske fasen. Det hydrofobe komplekset vil migrere inn den organiske fasen. Ved grenseflaten mellom organisk fase og akseptorløsningen frigjøres peptidet igjen.
Valg av pH i prøveløsningen og akseptorløsningen er også viktig, da det er ønskelig med en positiv nettoladning på peptidene for å oppnå migrasjon mellom de tre fasene. Høyest utbytter ble oppnådd ved å velge pH 3,0 i prøveløsningen og pH 1,0 i akseptorløsningen.
Også spenningsstyrke og ekstraksjonstid kan påvirke utbyttene.
Resultater
Ekstraksjonsutbyttene etter fem minutter med EME av de åtte ulike peptidene er vist i tabell 1. Med optimale ekstraksjonsbetingelser (nevnt over) har det blitt oppnådd utbytter på i overkant av 50 %. Peptidenes struktur er den viktigste faktoren forresultatet av ekstraksjonsprosessen. De mest hydrofobe peptidene, som samtidig har en høy positiv nettoladning, har høyest ekstraksjonsutbytter. Som vist i tabell 1 er det tripeptidet IPI som har høyest utbytte (53 %) og høyest oppkonsentreringsfaktor (11,2), fulgt av Angiotensin 2 og Angiotensin 3. Utbyttene er derimot lave for de mer hydrofile peptidene med lav eller ingen positiv nettoladning.
Konklusjon
EME er en lovende og helt ny teknikk for raskt å kunne isolere og oppkonsentrere peptider. Frem til nå er all forskning gjort på vandige prøveløsninger, mens videre arbeid vil fokusere på ekstraksjon av peptider fra mer komplekse matrikser, som plasma. Konseptet kan bli viktig i fremtidig peptidanalyse som en potensiell og innovativ prøveopparbeidelsesmetode av peptider fra ulike matrikser.
Referanser
- S. Pedersen-Bjergaard, K.E. Rasmussen, Analytical Chemistry, 71 (1999) 2650.
- S. Pedersen-Bjergaard, K.E. Rasmussen, Journal of Chromatography A 1109, (2006) 183.
- A. Gjelstad, T.M. Andersen, K.E. Rasmussen, S. Pedersen-Bjergaard, Journal of Chromatography A 1157, (2007) 38.
- A. Gjelstad, K.E. Rasmussen, S. Pedersen-Bjergaard, Journal of Chromatography A 1124, (2006) 29.
- M. Balchen, A. Gjelstad, K.E. Rasmussen, S. Pedersen-Bjergaard, Journal of Chromatography A 1152, (2007) 220.
- A. Gjelstad, K.E. Rasmussen, S. Pedersen-Bjergaard, Journal of Chromatography A 1174, (2007) 104.
(Publisert i NFT nr. 1/2008 side 22–23.)
