Betydningen av det ultraraske CYP2C19*17-genet for escitalopram
Ida Rudberg1, Beata Mohebi2, Monica Hermann1, Helge Refsum1, Espen Molden1,2
1. Psykofarmakologisk avdeling, Diakonhjemmet Sykehus
2. Avdeling for farmasøytisk biovitenskap, Farmasøytisk institutt, UiO
Escitalopram er i dag det mest brukte antidepressive legemidlet i Norge (1). Escitalopram metaboliseres primært av enzymet CYP2C19, og i mindre grad av CYP3A4 og CYP2D6 (2-4). CYP2C19 utviser genetisk polymorfisme, dvs. at genet som koder for dette enzymet foreligger i ulike varianter. I tillegg til normalgenet (CYP2C19*1) har det lenge vært kjent at det forekommer genvarianter som gir defekt enzym (CYP2C19def). Tidligere studier har vist at individer som bærer en defekt kopi (CYP2C19*1/def) eller to defekte kopier (CYP2C19def/def) av CYP2C19-genet har høyere eksponering for escitalopram sammenliknet med individer som har to kopier av normalgenet (CYP2C19*1/*1) (5,6).
Nylig ble det beskrevet en variant av CYP2C19-genet som kodet for økt aktivitet av CYP2C19-enzymet (7). Denne genvarianten fikk betegnelsen CYP2C19*17. Sim et al. antydet at ultrarask metabolisme via CYP2C19 forårsaket av CYP2C19*17 kan gi terapisvikt ved behandling med CYP2C19-substrater, som for eksempel protonpumpehemmere og en del antidepressiva. På bakgrunn av dette ønsket vi å undersøke betydningen av CYP2C19*17 for serumkonsentrasjonen av escitalopram. Studien er i sin helhet publisert i Clinical Pharmacology and Therapeutics (8).
Gjennomføring
Psykofarmakologisk avdeling utfører serumkonsentrasjonsmålinger av psykofarmaka, deriblant escitalopram. Ved serummonitorering av escitalopram måles også N-demetyl escitalopram, som er én av flere kjente metabolitter av escitalopram. I tillegg utfører Psykofarmakologisk avdeling rutinemessig genotyping av CYP-enzymer. Ved hjelp av avdelingens database ble pasienter som både har målt serumkonsentrasjon av escitalopram og foretatt CYP-genotyping identifisert. Dosejusterte serumkonsentrasjoner (escitalopram og N-demetyl escitalopram, nM/mg) hos pasienter med én eller to kopier av den ultraraske genvarianten CYP2C19*17 ble sammenliknet med subgruppen som hadde to normale genkopier (CYP2C19*1/*1). Pasienter med defekte genkopier ble også sammenliknet med CYP2C19*1/*1-subgruppen. Statistiske beregninger ble utført ved hjelp av en linear mixed model analyse.
Totalt ble 281 serumkonsentrasjonsmålinger fra 166 genotypede pasienter inkludert i studien. Pasientene ble inndelt i seks subgrupper ut fra CYP2C19-genotype (CYP2C19*17/*17 (n=7), CYP2C19*17/*1 (n=43), CYP2C19*1/*1 (n=60), CYP2C19*17/def (n=16), CYP2C19*1/def (n=34) og CYP2C19def/def (n=6)).
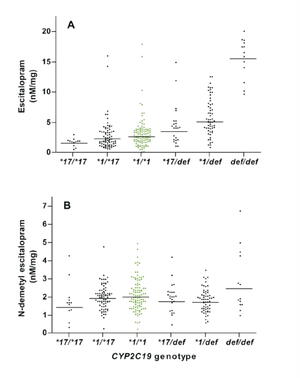
Figur 1. Dosejusterte serumkonsentrasjoner (nM/mg) av escitalopram (A) og N-demetyl escitalopram (B) i sammenheng med CYP2C19-genotype. Linjen indikerer gjennomsnitt estimert i mixed model analysen.
Hovedfunn og diskusjon
Det var en stegvis sammenheng mellom gjennomsnittlig serumkonsentrasjon av escitalopram og CYP2C19-genotype (figur 1A). Bærere av CYP2C19*17/*17-genotypen oppnådde signifikant lavere serumkonsentrasjon sammenliknet med CYP2C19*1/*1-subgruppen (42 %, p<0.01). Pasienter med to defekte genkopier (CYP2C19def/def) oppnådde omtrent seks ganger høyere gjennomsnittlig serumkonsentrasjon sammenliknet med CYP2C19*1/*1-gruppen (p<0.001).
CYP2C19*17 ga altså redusert serumkonsentrasjon av escitalopram, men effekten av denne genvarianten varbegrenset sammenliknet med effekten av de defekte CYP2C19-genvariantene. Dette underbygges av at det ble observert høyere gjennomsnittlig serumkonsentrasjon hos pasienter med den kombinerte ultrarask/defekt-genotypen (CYP2C19*17/def) sammenliknet med CYP2C19*1/*1-subgruppen (p=0.072). En 42 prosent lavere serumkonsentrasjon i CYP2C19*17/*17-subgruppen innebærer imidlertid at disse pasientene i gjennomsnitt må behandles med nesten dobbelt så høy dose som pasientene med CYP2C19*1/*1-genotype for å oppnå sammenliknbar serumkonsentrasjon. Dette kan gi grunnlag for å mistenke at individer som bærer CYP2C19*17/*17-genotypen (4-5 prosent av befolkningen) har økt risiko for terapisvikt ved behandling med standarddoser av escitalopram.
Totalt varierte gjennomsnittlig serumkonsentrasjon av escitalopram med en faktor på 9,7 mellom ulike CYP2C19-genotyper. Dette innebærer at samme dose gitt til ulike pasienter gir nesten 10 ganger forskjell i eksponering for escitalopram avhengig av genotype. Dette indikerer at dosering av escitalopram bør tilpasses pasientenes genotype for å redusere forskjeller i legemiddeleksponering og klinisk respons.
Serumkonsentrasjon av N-demetyl escitalopram viste ingen systematisk effekt av CYP2C19-genotype (figur 1B). Til tross for den betydelige effekten på modersubstansen, ser det altså ut til at CYP2C19-genetikk er uten betydning for serumkonsentrasjonen av N-demetyl escitalopram. En mulig forklaring kan være at CYP2C19-enzymet hovedsakelig er involvert i andre metabolismeveier enn N-demetylering av escitalopram.
Konklusjon
CYP2C19-genetikk er en viktig årsak til variasjon i serumkonsentrasjon av escitalopram. Pasienter med CYP2C19*17/*17-genotypen oppnår lavere serumkonsentrasjon av escitalopram sammenliknet med CYP2C19*1/*1-subgruppen. Videre studier bør kartlegge om pasienter med CYP2C19*17/*17-genotype utgjør en subpopulasjon (4-5 prosent av befolkningen) med økt risiko for terapisvikt ved behandling med escitalopram.
Referanser
- Nasjonalt folkehelseinstitutt, Legemiddelforbruket i Norge 2002-2006. www.legemiddelforbruk.no Aksessert 2/9-07
- Rochat B, Amey M, Gillet M, Meyer UA, Baumann P. Identification of three cytochrome P450 isozymes involved in N-demethylation of citalopram enantiomers in human liver microsomes. Pharmacogenetics 1997; 7: 1-10.
- Olesen OV, Linnet K. Studies on the stereoselective metabolism of citalopram by human liver microsomes and cDNA-expressed cytochrome P450 enzymes. Pharmacology 1999; 59: 298-309.
- von Moltke LL, Greenblatt DJ, Giancarlo GM et al. Escitalopram (S-citalopram) and its metabolites in vitro: cytochromes mediating biotransformation, inhibitory effects, and comparison to R-citalopram. Drug Metab Dispos. 2001; 29: 1102-1109.
- Herrlin K, Yasui-Furukori N, Tybring G et al. Metabolism of citalopram enantiomers in CYP2C19/CYP2D6 phenotyped panels of healthy Swedes. Br.J.Clin.Pharmacol. 2003; 56: 415-421.
- Rudberg I, Hendset M, Uthus LH, Molden E, Refsum H. Heterozygous mutation in CYP2C19 significantly increases the concentration/dose ratio of racemic citalopram and escitalopram (S-citalopram). Ther.Drug Monit. 2006; 28: 102-105.
- Sim SC, Risinger C, Dahl ML et al. A common novel CYP2C19 gene variant causes ultrarapid drug metabolism relevant for the drug response to proton pump inhibitors and antidepressants. Clin.Pharmacol.Ther. 2006; 79: 103-113.
- Rudberg I, Mohebi B, Hermann M, Refsum H, Molden E. Impact of the ultrarapid CYP2C19*17 allele on serum concentration of escitalopram in psychiatric patients. Clin.Pharmacol.Ther. 2007 [Epub ahead ofprint].
(Publisert i NFT nr. 2/2008 side 23–24.)
