Ciklosporin A – utvikling av en farmakokinetisk populasjonsmodell
Tekst: Live Storehagen, Pål Falck og Anders Åsberg,
Avdeling for farmasøytisk biovitenskap, Farmasøytisk institutt,
Universitetet i Oslo
BAKGRUNN
Ciklosporin A (CsA) er en viktig hjørnestein i den immunosuppressive behandlingen av nyretransplanterte pasienter. I 2005 brukte ca. 75 % av nyretransplanterte pasientene CsA (1). CsA ble introdusert som et immunsuppressivt legemiddel i begynnelsen av 1980-tallet, og det medførte en betydelig økt overlevelsesrate hos nyretransplanterte pasienter, og muligheten til å transplantere andre organer som hjerte og lunger (2, 3).
CsA har et smalt terapeutisk vindu. Konsentrasjoner over det terapeutiske vinduet er assosiert med en rekke alvorlige bivirkninger som nyretoksisitet, hypertensjon, utvikling av diabetes og dyslipidemi, mens konsentrasjoner under det terapeutiske vinduet er assosiert med risiko for organrejeksjon. I tillegg viser CsA stor inter- og intraindividuell farmakokinetisk variasjon, spesielt i absorpsjonsfasen (figur 1). På grunn av dette styres doseringen av CsA ved hjelp av rutinemessig blodkonsentrasjonsmålinger.
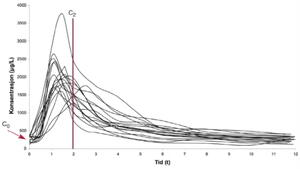
Figur 1. Interindividuell variasjon hos de nyretransplanterte pasientene som er brukt i denne studien til å bygge opp den farmakokinetiske populasjonsmodellen (n=17).
CsA monitoreres i dag hovedsakelig ved å måle blodkonsentrasjoner to timer etter inntatt dose (C2), se figur 1. Dette har vist seg å være den enkeltmålingen som best korrelerer med klinisk utfall (4), også i forhold til såkalte trough-verdier (5), som er blodkonsentrasjon av CsA rett før inntatt dose (C0) og som var den tradisjonelle metoden å monitorere doseringen av CsA på tidligere.
MÅL
Til tross for at monitorering av CsA ved hjelp av C2-målinger har gitt bedre resultater er det fortsatt behov for å optimalisere doseringen til den enkelte pasient ytterligere. En populasjonsmodell vil kunne være et nyttig verktøy til dette. En slik modell kan predikerer individuelle farmakokinetiske parametere, ikke bare basert på de enkelte pasientobservasjoner, men også ved hjelp av populasjonsdata.
Målet med studien var å utvikle en populasjonsmodell for CsA, som kan benyttes til å optimalisere doseringen av nye nyretransplanterte pasienter i fremtiden.
METODE
NONMEM, som er et av de mest brukte dataverktøyene for populasjonskinetikk, ble brukt til den farmakokinetiske modelleringen. Pasientdata fra 17 nyretransplanterte pasienter med informasjon fra 12-timers konsentrasjonsprofiler i et doseintervall (figur 1) ble implementert i NONMEM til utvikling av populasjonsmodellen. Alle pasientene var i en stabil fase i løpet av de tre første månedene etter transplantasjon.
Ulike modeller for hvordan CsA tas opp i kroppen (absorpsjonsprosesser) og videre distribueres ut i kroppen ble undersøkt. I tillegg ble påvirkning av vekt, nyrefunksjon, alder, høyde, kjønn, tid etter transplantasjon, diabetes og prednisolon-dose undersøkt. Den ferdige modellen ble internt validert, og i tillegg testet på en ekstern gruppe bestående av ti nye nyretransplanterte pasienter som ikke inngikk i oppbyggingen av modellen.
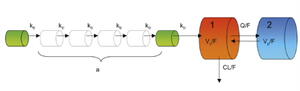
Figur 2. 2-kompartment modell med Erlang distribusjon i absopsjonsfasen. Den farmakokinetiske modellen som best beskrevkinetikken til CsA.
Resultater
En farmakokinetisk modell bestående av to kompartment, hvor fullblodskonsentrasjoner av CsA ble målt i det sentrale kompartment 1 og kompartment 2 representerer perifere vev i kroppen, beskrev distribusjonen av CsA best, se figur 2. Absorpsjonsfasen til CsA ble best beskrevet ved å legge til seks identiske absorpsjonskompartment i absorpsjonsfasen, som legemiddelet passerer før det når kompartment 1 (figur 2). Denne måten å beskrive absorpsjonen på blir kalt Erlang distribusjon (6). Ved å bruke denne modellen i NONMEM ble de observerte konsentrasjonene godt predikert, som vist i figur 3, noe som tyder på at modellen beskriver CsA-kinetikk tilfredstillende.
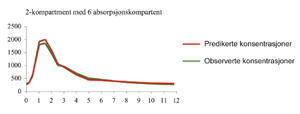
Figur 3. Konsentrasjon-tid-profil for 2-kompartment modell med Erlang distribusjon i absorpsjonsfasen. Den røde linjen er de predikerte konsentrasjonene av NONMEM, mens den grønne linjen er de observerte/målte konsentrasjonene.
Av de undersøkte pasientdemografiske faktorene, var det kun alder som viste en signifikant betydning for estimering av clearance. Det kan allikevel være mulig at det finnes andre kofaktorer som har signifikant betydning for modellen, men at disse ikke ble identifisert på grunn av et for lite og homogent pasientmaterialet.
Den ferdige modellen ble først validert med interne valideringsmetoder, som viste at den farmakokinetisk populasjonsmodellen var robust. I tillegg var det ingen av enkeltpasientene som viste stor innflytelse på estimering av de farmakokinetiske parameterne. Modellen predikerer AUC* over doseintervallet med stor nøyaktighet hos pasientene basert på begrenset informasjon (alder, dose og enkeltmålinger), se tabell 1. Absolutt avvik i predikering av individuelle AUC-verdier var 18,6 % ved å kun gi informasjon om den enkelte pasients alder og CsA-dose. Avviket ble betydelig redusert (ned mot 6 %) ved å legge til informasjon om én eller flere enkeltmålinger innenfor absorpsjonsfasen, i tillegg til pasientens alder og dose.
![]()
Tabell 1. Absolutt avvik i predikasjon av AUC angitt i prosent etter å inkludere CsA-dose, pasientalder og fullblodskonsentrasjoner av CsA ved ulike tidspunkter.
Populasjonsmodellen ble deretter testet på en ekstern gruppe bestående av 10 nyretransplanterte pasienter, og dette viste at individuelle AUC-verdier ble predikert med stort sett den samme nøyaktigheten som i den interne valideringsmetoden. Det absolutte avviket i predikering av individuelle AUC-verdier var 23.4 % basert på informasjon om kun pasientens alder og dose. Avviket ble også her betydelig redusert (ned mot 5 %) ved å legge til informasjon om én eller flere enkeltmålinger innenfor absorpsjonsfasen.
KONKLUSJON
En 2-kompartmentmodell med en forsinket absorpsjonsprofil (Erlang distribusjon) og alder som en kofaktor for clearance beskrev CsA-dataene tilfredsstillende. Denne modellen er et godt utgangspunkt for den videre utviklingen av en modell som kan brukes til å optimalisere doseregime hos nye nyretransplanterte pasienter i klinisk praksis.
VIDERE ASPEKTER
Arbeidet videre består nå i å inkludere flere pasienter over et større tidsområde etter transplantasjon, for å optimalisere populasjonsmodellen og undersøke om det kan være andre pasientfaktorer som har betydning for estimering av individuelle farmakokinetiske parameterverdier. Dette vil forhåpentligvis gjøre modellen mer robust, med mindre sannsynlighet for at modellen «bommer» på pasienter som avviker mer fra populasjonsgjennomsnittet. Den endelige populasjonsmodellen skal så testes i klinikken. Det videre arbeidet jobbes detaktivt med på Avdelingen for farmasøytisk biovitenskap ved Universitetet i Oslo.
Referanser
- N. nefrologiregister. Årsrapport. 2006.
- S. Hariharan, et al., Improved graft survival after renal transplantation in the United States, 1988 to 1996. N Engl J Med, 2000. 342(9): 605–12.
- E.M.T. Group, Cyclosporin in cadaveric renal transplantation: one-year follow-up of a multicentre trial. Lancet, 1983. 2(8357): 986–9.
- E. Thervet, et al., Clinical outcomes during the first three months posttransplant in renal allograft recipients managed by C2 monitoring of cyclosporine microemulsion. Transplantation, 2003. 76(6): 903–8.
- K. Mahalati, et al., Neoral monitoring by simplified sparse sampling area under the concentration-time curve: its relationship to acute rejection and cyclosporine nephrotoxicity early after kidney transplantation. Transplantation, 1999. 68(1): 55–62.
- J.H. Matis and T.E. Wehrly, Generalized stochastic compartmental models with Erlang transit times. J Pharmacokinet Biopharm, 1990. 18(6): 589–607.
*AUC= Area under the curve. Mål på total systemisk eksponering av legemiddelet.
(Publisert i NFT nr. 3/2008 side 22–23.)
