PAT: Nye prinsipper for kvalitetskontoll av legemidler og styring av produksjonsprosesser
Øyvind Holte

Øyvind Holte. Foto: Svein Sikle/Statens
legemiddelverk
Tekst: Øyvind Holte, cand.pharm., dr.scient.
Statens legemiddelverk
For godkjente legemidler er ingredienser og prosessparametere definert i dokumentasjonen som er godkjent i forbindelse med utstedelse av markedsføringstillatelsen. For mange preparater har dermed produsenten liten grad av frihet til å tilpasse produksjonsprosessen etter forholdene, selv om det ville være ønskelig. Som eksempel kan nevnes en tørkeprosess som vil kunne påvirkes av luftfuktigheten i produksjonslokalene og batch-til-batch-variasjoner i råvarenes vanninnhold.
Et typisk eksempel på teknologi som kan brukes til forståelse og kontroll av produksjonsprosesser er NIR-spektroskopi, der raske datamaskiner er uunnværlige i fortolkningen av spekteret. Metoden er rask og gir relevant informasjon om kvaliteten av enkeltstoffer og blandinger. Sammen med andre nye analysemetoder som samlet går under betegnelsen «PAT tools» bidrar dette til at produksjonsprosessen kan studeres og overvåkes mer nøyaktig og også justeres underveis innenfor validerte rammer. Figur 1 illustrerer forskjellen mellom de to ulike prinsippene for prosesskontroll.
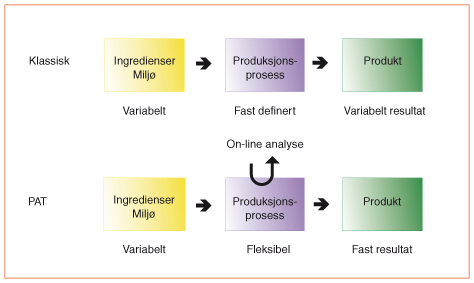
Figur 1. Prinsipper for prosesskontroll
PAT-analysemetoder
I 2002 gjorde de amerikanske legemiddelmyndighetene (FDA) et initiativ overfor den farmasøytiske industrien der de oppfordret til å nyttiggjøre seg i større grad de nye metodene som samlet omtales som prosessanalytisk teknologi (PAT)(1). Felles for PAT-analysemetodene er at de er ikke-destruktive, kan analysere prøver on-line eller in-line og gir raskt prøvesvar. Dermed innebærer analysen ingen forringelse av prøven eller noen tidkrevende prøveopparbeidelse. Den raske analysetiden gjør det mulig å justere prosessen fortløpende på grunnlag av analysesvarene.
PAT gir en grundigere forståelse av produktet og produksjonsprosessen og en bedre kontroll med selve prosessen enn det som er mulig med klassiske analysemetoder. Bruk av PAT vil derfor kunne gi høyere utbytte, høyere kvalitet og mer effektiv produksjon. Det vil også kunne åpnes for større regulatorisk fleksibilitet, det vil si at visse endringer i ingredienser eller produksjonsprosesser ikke nødvendigvis vil kreve godkjenning fra myndighetene. Full utnyttelse av PAT vil kunne redusere eller eliminere behovet for klassisk sluttkontroll av batcher.
De nyeste ICH-retningslinjene innenfor kvalitetsområdet (Q8 med tillegg, Q9, Q10) beskriver prinsipper og metoder som er uunnværlige for en vellykket bruk av PAT i farmasøytisk produksjon (2-5). Systematisk forsøksdesign og multivariat dataanalyse er sentrale stikkord i tillegg til de nye analysemetodene som er nevnt ovenfor.
Referanser
- Guidance for Industry: PAT - A Framework for Innovative Pharmaceutical Development, Manufacturing and Quality Assurance. www.fda.gov/CDER/GUIDANCE/6419fnl.pdf
- ICH Q8: PharmaceuticalDevelopment www.ich.org/LOB/media/MEDIA1707.pdf
- Tillegg til ICH Q8 www.ich.org/LOB/media/MEDIA4349.pdf
- ICH Q9: Quality Risk Management www.ich.org/LOB/media/MEDIA1957.pdf
- ICH Q10: Pharmaceutical Quality System www.ich.org/LOB/media/MEDIA3917.pdf
(Publisert i NFT, nr. 1/2009 side 16.)
