Gentesting i apotek – fremtid eller fantasi?

Espen Molden (f. 1972) er utdannet cand.pharm. Han er forskningsleder ved Senter for Psykofarmakologi, Diakonhjemmet Sykehus og professor II ved Farmasøytisk institutt, Universitetet i Oslo.
Det er ikke fantasi at apotek kan identifisere behov for eller fasilitere farmakogenetiske analyser, men økt kompetanse blant apotekfarmasøyter er nødvendig for at det skal bli fremtid.
Hovedbudskap
- Medfødte farmakogenetiske forskjeller er en av de viktigste kildene til bivirkninger og mangelfull effekt av legemidler.
- Klinisk bruk av farmakogenetiske analyser er stadig økende. Prøvesvar fra slike analyser har livslang verdi for individtilpasset legemiddelbehandling på tvers av ulike terapiområder.
- Apoteket er en egnet arena for å identifisere behov for farmakogenetiske analyser, men det å utføre en slik oppgave krever kompetanse utover det apotekfarmasøyter generelt har i dag.
Barack Obama er kjent for mye, men ikke mange vet at han i 2015 innførte «precision medicine» (presisjonsmedisin) som et begrep. Begrepet ble lansert i en pressemelding som kommuniserte økt satsing på å optimalisere legemiddelbehandlingen til den enkelte pasient. Konseptet var ikke nytt, det hadde tidligere blitt omtalt som «tailored drug treatment» (skreddersydd legemiddelbehandling) eller «personalized medicine» (persontilpasset medisin).
Som Obama påpekte i sin pressemelding, er det mange ulike kilder til individuell variasjon i legemiddelrespons – for eksempel:
- Kosthold, livsstil (blant annet røyking)
- Alder, kjønn
- Organfunksjon (blant annet nyrefunksjon)
- Legemiddel/legemiddel-interaksjoner
- Gen/legemiddel-interaksjoner (farmakogenetikk).
Legemiddel/legemiddel- vs. gen/legemiddel-interaksjon
Interaksjoner mellom samtidig brukte legemidler er en viktig årsak til bivirkninger eller sviktende behandlingseffekt. Tilsvarende vil interaksjoner mellom gener (genvarianter) og legemidler forårsake bivirkninger eller mangelfull effekt.
Poenget over kan illustreres med interaksjonen mellom metoprolol, som metaboliseres via CYP2D6, og antidepressiva som er potente hemmere av CYP2D6 (fluoksetin, paroksetin og bupropion). Denne interaksjonen medfører at eksponeringen av metoprolol i gjennomsnitt øker fem ganger, det vil si at en dosering på 100 mg i praksis får en effekt som tilsvarer 500 mg. Dette er utvilsomt en klinisk relevant problemstilling («bør unngås»-interaksjon). I europeiske befolkningsgrupper er 5–10 prosent født uten CYP2D6-metabolisme på grunn av genetiske forhold. Disse vil få fem ganger høyere eksponering ved en gitt dose av metoprolol sammenliknet med personer som har normal metabolisme, altså tilsvarende effekt som for interaksjonen mellom metoprolol og potente CYP2D6-hemmere.
Rundt 7000 personer kombinasjonsbehandles årlig med metoprolol og potente CYP2D6-hemmende antidepressiva. Til sammenlikning er antallet metoprololbehandlede personer med medfødt defekt CYP2D6-metabolisme drøyt 20 000. Dette illustrerer at omfang og klinisk betydning av farmakogenetiske forskjeller er minst like viktig som interaksjoner for individuell variasjon i legemiddelrespons.
Utbredelse av farmakogenetisk testing i Norge
Farmakogenetiske analyser utføres i dag ved flere norske spesiallaboratorier med utgangspunkt i DNA fra blodprøver (PCR-baserte metoder). Vårt laboratorium ved Diakonhjemmet Sykehus utfører flest farmakogenetiske analyser i Norge (i 2017 anslagsvis 5000). Alle analysesvarene gjennomgår grundig tolkning av klinisk betydning i relasjon til aktuell legemiddelbruk og problemstilling/indikasjon som legen har oppgitt ved bestillingen. Tolkningen utføres av spesialisert farmasøyt eller klinisk farmakolog, som også gir praktiske råd til behandlende lege basert på analysesvaret. Dette er essensielt for at det farmakogenetiske analysesvaret skal ha en klinisk nytteverdi.
CYP-genotyping er vanligste test og omfatter analyse av CYP2C9, CYP2C19 og CYP2D6, som er enzymer involvert i metabolisme av mange legemidler innenfor ulike terapiområder. Siden genotype ikke endres med alder, betyr det at farmakogenetiske analysesvar kan gjenbrukes for livslang tilpasning av den enkelte pasients legemiddelbehandling. Kostnaden ved en CYP-test ligger med dagens offentlige takster på drøyt 1000 kroner. Dette er lite sammenliknet med den potensielle nytteverdien analysesvaret har i et livslangt perspektiv. Realisering av gevinsten krever imidlertid at analysesvaret følger pasienten gjennom helsevesenet og gjenbrukes. I tillegg må beslutningstakere (leger, og eventuelt farmasøyter) ha tilstrekkelig kompetanse til å benytte informasjonen som grunnlag for persontilpasset valg av legemiddel og dosering.
God indikasjon for å utføre farmakogenetisk analyse er også viktig. En konservativ indikasjon er å teste i tilfeller der pasienter opplever bivirkninger/terapisvikt av legemidler som berøres av aktuelle genvarianter (for eksempel bestemte CYP-genotyper). Denne indikasjonen er i dag mest vanlig, men analysesvaret bidrar i årsaksvurdering av bivirkninger eller dårlig effekt, og er dermed en form for retrospektiv (problemutredende) testing. En annen tilnærming er å utføre farmakogenetisk testing prospektivt, det vil si ved behandlingsstart, for å forebygge bivirkninger eller mangelfull effekt. Dette krever at en genotype er vist å være av kritisk betydning for behandlingsutfallet. Et eksempel er forventet langvarig behandling med psykofarmaka, der mange problemer kan forebygges ved kjennskap til CYP-genotyper. Andre eksempler er legemidler gitt som «prodrugs», der genotype har stor påvirkning på biologisk aktiveringsgrad, og dermed behandlingseffekt. Klopidogrel og tamoksifen er begge «prodrugs» som skal forebygge alvorlige hendelser (trombose og residiv cancer). Her har man ingen «surrogatmål» for å vurdere effekt under pågående behandling, slik man har ved bruk av eksempelvis warfarin (INR) og statiner (lipidverdier). Effektmål ved bruk av klopidogrel og tamoksifen er henholdsvis fravær av hjerteinfarkt/hjerneslag og residiv cancer. Det sier seg selv at dette er en irrasjonell måte å evaluere om behandlingen virker eller ikke.
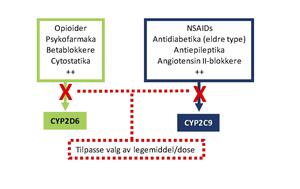
Uavhengig av indikasjon for farmakogenetiske analyser, er det viktig at informasjonen gjenbrukes (illustrert i figur, se ramme).
Apotekets fremtidige rolle
Apotek har en unik oversikt over pasientenes legemiddelbruk. Ved legemiddelsamtale gir dette et godt utgangspunkt for å avdekke bivirkninger/terapisvikt. I tillegg vil apoteket ofte fange opp førstegangsforskrivning av legemidler der farmakogenetiske forskjeller er kritisk for behandlingsutfall. Apoteket er derfor en egnet arena for å identifisere behov for farmakogenetiske analyser.
Et fremtidsscenario der apoteket tilbyr farmakogenetiske analyser, som en direktetjeneste til legemiddelbrukere, er ikke umulig. For å imøtekomme lovmessige og metodologiske krav vil imidlertid en slik modell kreve samarbeid med et spesiallaboratorium.
Uavhengig av hvordan, er det svært sannsynlig at apoteket i fremtiden får tilgang til farmakogenetiske data. Dette blir et faglig løft som pasienter forhåpentligvis får nytte av, men bransjen må være ydmyk for at implementering av farmakogenetisk informasjon i medikamentell beslutningsstøtte krever spisskompetanse.
PASIENTEKSEMPEL
Kasuistikk som illustrerer potensiell klinisk betydning og gjenbruksverdi av farmakogenetiske data (for nærmere detaljer om pasienthistorie, se Tidsskr Nor Legeforen 2008;128: 1677–9):
- Hjertesviktpasient med trombose starter behandling med warfarin (Marevan) etter normal prosedyre (7,5 mg første og andre dag) INR havner umiddelbart over terapeutisk område, og blir værende >3 i 14 dager uten ny dosering av Marevan.
- CYP-genotyping viser at pasienten er født uten metabolisme via enzymene CYP2C9 og CYP2D6. Svaret forklarer unormal Marevan-respons, og viser at doseringen bør ligge på cirka 1,25 mg per uke. Analysesvaret forklarer også andre problemstillinger, blant annet hvorfor pasienten ikke tolererer metoprololdoser >25 mg per dag.
- Analysesvaret forklarte legemiddelproblemer ved det aktuelle tidspunktet, og representerer samtidig kritisk informasjon for fremtidig valg av legemiddelbehandling. Eksempelvis forutsier analysesvaret at pasienten ikke vil få effekt av «prodrug»-opioider (kodein og tramadol), samtidig som at bivirkningsrisiko av de fleste NSAIDs vil være økt (illustrert i figuren under).
(Publisert i NFT nr. 10/2017 side 19-20.)
