Morfin – det første alkaloidet som ble isolert rent

Papaver somniferum
Tørket saft fra opiumsvalmuen, Papaver somniferum (se bilde), har i over 3500 år blitt brukt i medisinsk sammenheng (1). Ordet opium kommer fra greske ordet opos som betyr saft. Hovedinnholdet i opium, morfin (og kjemiske derivater, se figur 1), er fortsatt i dag de viktigste legemidlene man har for behandling av sterke smerter. Opium inneholder over 40 alkaloider hvorav de fire mest kjente er: morfin (10–20 % av massen) (2), kodein (≥ 2,5 %), noskapin (≥ 8 %) og tebain. Noskapin brukes som hostedemper. Tebain er et viktig råstoff for kjemisk produksjon av forskjellige semisyntetiske derivater. Opium inneholder også papaverin, som blant annet har vært brukt mot muskelspasmer.
Hvordan virker morfin?
Navnet morfin kommer fra det greske ordet Morpheus, et navn for drømmenes gud, siden det er søvninduserende. Morfin og andre opioider med smertestillende egenskaper fungerer som agonister på opioidreseptorer i sentralnervesystemet (CNS). Opioidreseptorene er såkalte G-proteinkoblete reseptorer og blir aktivert av opioider som gir signaler om å blant annet hindre enzymet adenylate cyclase. Når dette skjer blir produksjon av cAMP nedregulert, celler skiller ut K+-ioner og stenger spenningsregulerte Ca2+ ionekanaler. Overalt fører dette til endringer i membranspenning i nerveceller og sterk inhibering av nervesignaler. Det finnes flere undertyper av hver reseptorklasse (μ-, κ- og δ) og forskjellige opioider har forskjellig affinitet for hver reseptor og undertype. Dette gir opphav til forskjellige profiler av smertelindring, rus/eufori, CNS-depresjon og toleranseutvikling blant forskjellige opioidagonister (3). Vanlige bivirkninger av morfin og opioider som aktiverer reseptorene er nedsatt CNS-aktivitet, rus, kvalme/oppkast og forstoppelse. I tillegg sløver en del opioider hosterefleksen, og noskapin, kodein og etylmorfin brukes alle for å behandle tørrhoste. I tillegg vil blodtrykket bli nedsatt og svimmelhet kan forekomme. Sammentrekning av pupillene er også et vanlig tegn på opioidbruk. Et av de største problemene med bruk av opioider er avhengighet og utvikling av toleranse som skjer raskt. En overdose kan føre til stopp i ventilasjon og død.
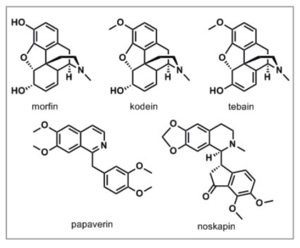
Figur 1. Viktige alkaloider i opium.
Oppdagelsen av morfin
Et problem som ble mer og mer tydelig, jo mer utbredt opium ble, var at kvaliteten varierte. Mengden aktivt stoff i opium varierte, og det gjorde at effekten varierte mye. Tidlig på 1800-tallet ble det gjort flere forsøk på å isolere den eller de aktive substansene i opium.
Den nøyaktige tidslinjen for når og hvordan morfin først ble isolert fra opium er litt uklar. Noen kilder sier 1803, andre 1804, men alle er samstemte i at det var den tyske apotekeren Friedrich Wilhelm Adam Sertürner (se bilde) som først isolerte morfin (4). Sertürner jobbet som apotektekniker i Paderborn og publiserte i 1805 og 1806 oppdagelsen av mekonsyre og morfin, men funnene ble i stor grad oversett av det vitenskapelige miljøet (5, 6). Det var først i 1817, da han publiserte oppdagelsen og isoleringen av morfin i tidsskriftet Annalen der Physik at andre virkelig oppdaget arbeidet hans (7). Sertürner beskrev morfin som svakt basisk, løselig i surt vann, og som felte ut i ammoniakk. C.F. Wilhelm Meissner, en annen tysk apoteker, beskrev i 1819 basiske naturprodukter av samme type som Sertürner og gav dem navnet alkaloider. Morfin ble derfor det første alkaloidet som ble isolert. Andre kjente alkaloider som ble isolert på attenhundretallet inkluderer kinin, atropin, koffein, nikotin, kokain og stryknin.
Opium og opiumekstrakter dominerte fortsatt som medisin i mange år etter oppdagelsen isolering av morfin. Kommersiell produksjon av morfin begynte på 1820-tallet i Europa og på 1830-tallet i USA. Populariteten av morfin skjøt først fart etter oppdagelsen av injeksjonsnålen i 1850-årene (8).
Fremgangsmåte for isolering av morfin fra opium
Sertürner isolerte morfin ved å vaske tørket opium med små mengder destillert vann til ekstraktet ble fargeløst. Vannet ble så mettet med ammoniakk som felte ut urent morfin. Etter filtrering ble råproduktet så løst i tynn svovelsyre og felt ut ved hjelp av ammoniakk. Dette var et mye renere produkt, men det måtte så omkrystalliseres gjentatte ganger fra etanol for å bli helt rent. Utbyttet lå på omtrent 8–12 % før omkrystalliseringene fra etanol.
Det er også mulig å utnytte at morfin har en svakt sur fenol, som gjør at morfin kan løses i basisk vann. De fleste andre alkaloidene i opium vil ikke løses i basisk vann, og morfin kan derfor selektivt løses og så felles ut ved å nøytralisere løsningen.
Første tester av morfin på dyr og mennesker
Sertürner hadde tidlig i sine undersøkelser av opium sett at alkoholekstraker gav søvndyssende effekter. Han testet derfor konsentrerte ekstrakter av opium på løshunder, i doser på opptil 780 milligram. Han observerte at hundene kastet opp, fikk ukontrollerte rykninger og ble sløve, men ingen sovnet. Mest sannsynlig var dette ekstraktet ganske urent siden hundene ikke sovnet. Han skriver også at en hund døde i løpet av forsøket. Senere, i 1817, testet Sertürner effekten av ren morfin på seg selv og tre gutter «ikke eldre enn 17 år» (7). De fire inntok doser på cirka 32 milligram totalt fire ganger. Enten som en løsning i alkohol og vann eller som fast stoff. Effektene kom relativt raskt og de siste dosene førte til at guttene kastet opp og opplevde smerte. Sertürner drakk da selv eddik og fikk de andre til å gjøre det samme. De kastet opp alle sammen og sovnet. Slike forsøk ville selvsagt ikke vært lovlige i dag. Til tross for dette klarte Sertürner å vise at det var en komponent i opium som gav den biologiske effekten, og ble dermed en pioner innen eksperimentell farmakologi.
Strukturbestemmelse av morfin
Selv om morfin ble isolert i 1805, var det å bestemme strukturen en ganske komplisert oppgave. Det første sporet kom i 1847 da den franske kjemikeren Auguste Laurent klarte å lage salter av vannfritt morfin, og dermed finne den riktige summeformelen for en dimer av morfin, C34H38N2O6, som tilsvarer C17H19NO3 for morfin (9).
Den britiske kjemikeren Sir Robert Robinson bestemte strukturen til morfin i år 1925 ved hjelp av degraderingsstudier og teoretisk innsikt i kjemisk bindingsteori og særlig stabiliteten til aromatiske systemer. Robertson fikk Nobelprisen i kjemi i 1947 for sine «studier av planteprodukter av biologisk betydning, spesielt alkaloidene».
Morfin har en komplisert struktur med flere stereogene sentre og stor tetthet av funksjonelle grupper og ringer som vanskeliggjør syntese. Den amerikanske kjemikeren Marshall D. Gates jr. gjennomførte den første totalsyntesen av morfin i 1952 (10, 11) og bekreftet dermed strukturen foreslått av Robinson, se synteseskjema 1. Siden har svært mange andre totalsynteser blitt publisert (12), men til tross for forbedringer i utbytter og antall trinn, er det usannsynlig at kjemisk totalsyntese vil bli foretrukket fremfor å isolere stoffet fra naturen. Amerikanske Kenner C. Rice publiserte i 1980 en bioinspirert totalsyntese av morfin som mange regner som den mest praktiske, se synteseskjema 2 (13), men selv denne er ikke i nærheten av å kunne konkurrere økonomisk med isolasjon av morfin fra opium.
Biosyntese av morfin
Morfin klassifiseres kjemisk som et bensylisokinolinalkaloid og biosyntiseres fra aminosyren L-tyrosin, se forenklet synteseskjema 3 (14). I de alle første trinnene blir to tyrosinmolekyler transformert til både dopamin og 4-hydroxyfenylacetataldehyd. Disse to tyrosinderivatene blir videre kondensert til (S)-norcolauren og inneholder bensylisokinolinkjernen. Videre gir en rekke med enzymatiske transformasjoner intermediatet (S)-retikulin etter 9 biosyntetiske trinn fra tyrosin. For å danne morfin blir (S)-retikulin enzymatisk omgjort til (R)-retikulin. Deretter fremstilles morfin via 9 trinn, blant annet metyleringer, oksideringer og ringdannende reaksjoner. Viktige mellomprodukter på veien fra (R)-retikulin mot morfin inkluderer tebain og kodein (14). Forskning har vist at morfin produseres også i spormengder i menneskeceller (15). Selv om dette ikke vil være nok mengder for å få frem smertestillende effekt, er det et veldig interessant funn og viser tegn på evolusjonær slektskap mellom mennesker og Papaver-planter.
Skjema 3. Forenklet biosyntese av morfin fra L-tyrosin.
Opium- og morfinproduksjon
Store deler av morfinproduksjonen gjøres fortsatt ved å manuelt samle tørket melk fra opiumsvalmuen. Dette er svært arbeidskrevende og må gjøres på riktig tidspunkt rett før valmuekapslene åpner seg. Arbeiderne må skjære små, grunne snitt i valmuefrøkapselen slik at en hvit væske renner ut. Denne «melken» størkner til en brun masse (opium) som må samles inn og som så kan videreforedles til morfin. Størstedelen av lovlig dyrket opium kommer fra India og blir brukt av legemiddelindustrien (16). Mye opium er også produsert på en ulovlig måte, spesielt i det såkalte gylne triangel (Laos, Thailand og Myanmar) og gylne halvmåne (Afghanistan, Pakistan og Iran) (15).
Opium kan også isoleres fra hele, tørkede planter. Denne prosessen er mer kostbar, men kan automatiseres lettere. Spania, Frankrike, Australia, Tyrkia og Ungarn står for størstedelen av verdens produksjon av morfin med denne metoden (17). Varmt klima er ikke nødvendig for å dyrke opiumsvalmuen, og opium av god kvalitet har blitt produsert i både Norge og Skottland (16). En stor del av alt ulovlig produsert opium er brukt for produksjon av heroin som kan fremstilles fra morfin via en enkel diasetylering (15).
«Nyere» og kjente varianter av morfin
Av alle opioider er det mest etterspørsel etter kodein, som gir omtrent 10 % av smertelindringen til morfin. Kodein har i seg selv lite bindingsaffinitet til opioidreseptorene, men blir delvis demetylert via enzymer til morfin og dette gir smertelindrende effekt. I tillegg er kodein en mindre vanedannende medisin enn morfin. Kodein produseres hovedsakelig fra morfin, ettersom relativt lite kodein finnes i opiumsvalmuene (15). Kodein er mye brukt i kombinasjonspreparater med paracetamol for behandling av moderat sterke smerter. Kodein har også hostedempende effekt, og det finnes andre opioider som har samme effekt, blant annet noskapin, etylmorfin og dekstrometorfan.
Heroin er et diacetylert derivat av morfin, er mer lipofilt molekyl og går raskere over blod-hjernebarrieren der det blir deacetylert tilbake til morfin. Heroin er enda mer avhengighetsskapende, men er fortsatt brukt på sykehus i noen land for behandling av sterke smerter, for eksempel i Storbritannia. Generelt sett har heroin skapt enorme problemer for samfunnet i de fleste land grunnet store avhengighetsskapende egenskaper.
Oksykodon, buprenorfin og etorfin (M99) fremstilles fra naturstoffet tebain med få syntetiske trinn (18). Etorfin er brukt for å bedøve elefanter og andre store dyr i veterinærmedisin. Oksykodon er mye brukt som et hurtigvirkende legemiddel mot moderate til sterke smerter. Buprenorfin er et mer fettløselig alkaloid og kan gis via hudplaster for smertelindring, eller på saltform som sublingvaltabletter for substitusjonsbehandling av opioidavhengighet. Andre syntetiske derivater som påvirker opioidreseptorene inkluderer tramadol, petidin, fentanyl og dekstrometorfan. Loperamid er en opioidreseptor agonist som ikke blir tatt opp i det sentrale nervesystemet og er brukt mot diaré. Nalokson er en antagonist som brukes på sykehus ved livsfarlige overdoser av opioder. Nalokson kan lages fra tebain.
Morfin og morfinderivater i fremtiden
Selv om mer enn 200 år har gått siden morfin ble først isolert, er det fortsatt viktig å drive forskning på denne enormt viktige klassen med medisiner. Opium har vært brukt i flere tusen år og i dag er opioider, enten naturlige eller syntetiske, fortsatt de viktigste medisinene man har for å behandle sterke smerter. En stor grunn for at det er viktig å forske videre på smertestillende medisiner er blant annet for å oppdage nye legemidler som har mindre bivirkninger, spesielt med hensyn til rusproblemer og misbruk, egenskaper som har skapt enorme problemer for verdens samfunn.
Referanser
Brook K, Bennett J, Desai SP. The Chemical History of Morphine: An 8000-year Journey, from Resin to de-novo Synthesis. J Anesth Hist 2017; 3: 50–5, https://doi.org/10.1016/j.janh.2017.02.001.
Jenkins AJ. Pharmacokinetics of specific drugs, In: Karch SB (editor), Pharmacokinetics and pharmacodynamics of abused drugs. Boca Raton: CRC Press, 2008.
Lemke TL, Williams DA, Foye WO. Foye’s principles of medicinal chemistry. 7th ed. pp. 666, 2013, Philadelphia: Wolters Kluwer Health / Lippincott Williams & Wilkins.
Hanzlik PJ. 125th Anniversary of the Discovery of Morphine by Sertürner, The Journal of the American Pharmaceutical Association, 1912, 18 (4), 375–84, https://doi.org/10.1002/jps.3080180413.
Sertürner FWA. Journal der Pharmacie für Aerzte, Apotheker und Chemisten 1805; 13: 229–43.
Sertürner FWA. Darstellung der reinen Mohnsäure (Opiumsäure) nebst einer chemischen Untersuchung des Opiums mit vorzüglicher Hinsicht auf einen darin neu entdeckten Stoff und die dahin gehörigen Bemerkungen. Journal der Pharmacie für Aerzte, Apotheker und Chemisten 1806; 14: 47–93.
Sertuerner FWA. Ueber das Morphium, eine neue salzfähige Grundlage, und die Mekonsäure, als Hauptbestandtheile des Opiums. Annalen der Physik 1817; 25: 56–89.
Hodgson B. In the Arms of Morpheus: The Tragic History of Laudanum, Morphine, and Patent Medicines. Buffalo, New York: Firefly Books, 2001.
Laurent A. Sur la composition des alcalis organiques et de quelques combinaisons azolées. Ann Chim Phys 1847; 19: 359–61.
Gates M, Tschudi G. The Synthesis of Morphine. J Am Chem Soc 1952; 74: 1109–10, DOI: 10.1021/ja01124a538.
Gates M, Tschudi G. The Synthesis of Morphine. J Am Chem Soc 1956; 78, 1380–93, DOI: 10.1021/ja01588a033.
Reed JW, Hudlicky T. Acc Chem Res 2015; 48: 674–87. DOI: 10.1021/ar500427k.
Rice KC. J Org Chem 1980; 45: 3135–7. DOI: 10.1021/jo01303a045.
Samuelsson G, Bohlin L. Drugs of Natural Origin: A Treatise of Pharmacognosy, 7. ed, pp 677–9, 2015.
Poeaknapo C et al. Endogenous formation of morphine in human cells. Proceedings of the National Academy of Sciences of the United States of America 2004; 101: 14091–6.
Evans WC. Trease and Evans' Pharmacognosy, 16. ed, pp 377–8, 2009.
United Nations Publication, United Nations, New York 2017, www.incb.org/documents/Narcotic-Drugs/Technical-Publications/2016/NAR_Part_II_Comments_EN.pdf.
Dewick PM. Medicinal natural products : a biosynthetic approach. 2nd ed., pp 329–37, Oxford: Wiley-Blackwell, 2002.
(Publisert i NFT nr. 9/2018 side 22-25)
