Fremskritt i behandlingen av inflammatorisk tarmsykdom
Tekst: Jørgen Jahnsen, dr.med., seksjonsoverlege,
Oslo universitetssykehus
Last ned atikkelen i pfd-format.
Hos genetisk disponerte individer skjer det en uheldig aktivering av immunsystemet i tarmslimhinnen som følge av en interaksjon med den naturlige forekommende bakteriefloraen i tarmen. Dette fører til dannelsen av en rekke forskjellige kjemokiner og cytokiner som bidrar i den inflammatoriske prosessen. Ved hjelp av moderne bioteknologi er det nå utviklet legemidler som blokkerer eller hemmer disse inflammatoriske mediatorene og på den måten påvirker sykdomsutviklingen. Tumor-nekrose-faktor-alfa (TNFα) er et proinflammatorisk cytokin med en sentral plass i patogenesen ved både ulcerøs kolitt og Crohns sykdom. Biologiske legemidler som hemmer dette cytokinet (TNFα-hemmere) er foreløpig de eneste som er godkjent i behandlingen av inflammatorisk tarmsykdom her i Norge:
Infliksimab (Remicade®)
Infliksimab (Remicade®) er et kimært humant-murint monoklonalt antistoff av typen IgG1 som binder både fritt og membranbunnet TNFα og er den første TNFα-hemmeren som ble tatt i bruk i behandlingen av inflammatorisk tarmsykdom. Infliksimab er godkjent for både ulcerøs kolitt og Crohns sykdom og administreres intravenøst (5 mg/kg kroppsvekt). Anbefalt regime er oppstartsbehandling med en infusjon uke 0, 2 og 6 og deretter en ny infusjon hver åttende uke. Infliksimab har vist seg å ha effekt ved kompliserende fistelsykdom.
Adalimumab (Humira®)
Adalimumab er et rekombinant humant monoklonalt antistoff av typen IgG1 rettet mot TNFα. Medikamentet ble først godkjent for bruk i behandlingen av Crohns sykdom, men har nå også indikasjonen ulcerøs kolitt. Adalimumab gis som subkutan injeksjon og ferdigfylt penn eller sprøyte kan benyttes. Dette kan pasientene læres opp til å administrere selv. Vanlig dosering er 40 mg hver annen uke etter at det initialt er gitt 160 mg uke 0 og 80 mg uke 2. Adalimumab synes også å ha en gunstig virkning på fistler.
Diskusjon om riktig bruk
Helt siden biologiske legemidler ble godkjent i behandlingen av inflammatorisk tarmsykdom for cirka 10 år siden har det vært en pågående diskusjon om riktig bruk. Det er ingen tvil om at TNFα-hemmerne er meget virksomme hos mange pasienter, men det er bekymringer knyttet til mulige alvorlige bivirkninger og store kostnader for samfunnet. I år ser det ser ut til at de direkte utgiftene til biologisk legemidler som benyttes i behandlingen av revmatiske sykdommer, fordøyelsessykdommer og hudsykdommer til sammen vil passere halvannen milliard kroner. På initiativ fra Helse- og omsorgsdepartementet er det utarbeidet nasjonale retningslinjer for bruken av biologiske legemidler innen de ulike medisinske spesialitetene som har disse i sitt armamentarium. Indikasjonen for bruk av TNFα-hemmere innen gastroenterologien er moderat til alvorlig ulcerøs kolitt og Crohns sykdom, hvor behandlingen med kortikosteroider og/eller immunhemmende medikamenter svikter. I tillegg til klare og uttalte symptomer og kliniske tegn må det ved behandlingsstart være sikker objektiv dokumentasjon på aktiv sykdom. Det vil si tydelige inflammatoriske forandringer ved endoskopisk undersøkelse av tarmen, forhøyet kalprotektinverdier i avføringen og/eller forhøyet C-reaktiv protein (CRP) i blodet. Bildediagostiske metoder som ultralyd og magnetisk resonans-undersøkelse (MR) kan også i noen tilfeller benyttes til å påvise aktiv inflammasjon. Før oppstart av behandling må samtidig tilstedeværende infeksjon utelukkes. Spesielt viktig er det å utelukke en latent tuberkulose, og Folkehelseinstituttet har utarbeidet retningslinjerfor dette. Det er nå vist at det er økt forekomst av alvorlige opportunistiske infeksjoner hos pasienter som får behandling med TNFα-hemmere. En annen fryktet komplikasjon er utvikling av kreft og da spesielt lymfom. Imidlertid er det så langt ingen klare signaler om at behandling med TNFα-hemmere gir økt risiko for kreftsykdom.
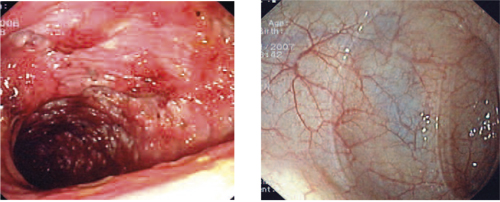
Bruk av biologiske legemidler har utvilsomt vært et stort fremskritt som har påvirket målsettingen for behandling av inflammatorisk tarmsykdom (se ramme). Et stort flertall av pasientene som får TNFα-hemmere opplever rask symptomlindring og sykdomskontroll som kan opprettholdes med et fast behandlingsregime. Hos mange pasienter har man sett normalisering av tarmslimhinnen (figur 1 og 2) og det er grunn til å tro at dette kan føre til endret sykdomsforløp, slik at det ikke oppstår fisteldannelse, strikturer og andre komplikasjoner som kan nødvendiggjøre sykehusinnleggelse og operasjon.
Fortsatt er det forhold som er uavklart når det gjelder behandlingen med biologiske legemidler. Det er veldokumentert at samtidig behandling med infliksimab og azathioprin har bedre effekt enn monoterapi mens det ikke er tilfredsstillende undersøkt om ko-medisinering til adalimumab har en gunstig virkning. Vi trenger prognostiske faktorer som kan bidra til å velge ut pasienter som vil profitere på tidlig oppstart av biologisk behandling. Det er også behov for å avklare om det finnes kriterier som tilsier at en behandling kan avsluttes med liten risiko for tilbakefall. I den senere tid har det dessuten vært mye fokus på måling av medikamentnivåer i blodet og at dette trolig innen kort tid blir et viktig hjelpemiddel til å optimalisere behandlingen med biologiske legemidler.
TNFα-hemmere er kun starten på en ny epoke i behandlingen av inflammatorisk tarmsykdom. En økende forståelse og kartlegging av immunologiske mekanismer som knytter seg til disse kroniske betennelsestilstandene vil med sikkerhet gi opphav til nye virksomme biologiske legemidler.
(Publisert i NFT nr. 1/2013 side 26–27.)
