Innkapslede celler som legemiddelform, del 1
Sammendrag
Hensikt
En kartlegging av mulige bruksområder for legemidler og preparater basert på innkapslede celler, og viktige problemstillinger knyttet til slike preparater, med særlig vekt på formulering.
Materialer og metoder
Bakgrunnsmaterialet er innhentet fra bidrag på Tissue Engineering workshop i regi av Den norske legeforening, TERMIS World Conference 2009 i Seoul, samt ved hjelp av databasen ISI Web of Science.
Resultater
Preparater basert på innkapslede celler brukes i form av probiotika i veterinær- og humanmedisin. Implantater til human bruk har lenge vært under utvikling.
Diskusjon
Vi peker på fire viktige utfordringer: Formulering, biokompatibilitet, tilgang til celler og regulatoriske hensyn. Noen av de viktigste utfordringene når det gjelder implanterbare, cellebaserte terapier knytter seg til formulering av egnede gelmatriser. Nøkkelord er næringstilgang, biokompatibilitet og tilpasning til spesifikke celletyper.
Konklusjon
Cellebaserte, legemiddelliknende terapier har i dag flere bruksområder innenfor human- og veterinærmedisin. Fremtidige bruksområder vil styres av utvikling i materialteknologi og dyrknings-/differensieringsmetode
Hovedbudskap
Innkapslede celler som implanterbare legemidler er en mulig løsning på flere medisinske problemer.
Formulering, biokompatibilitet, tilgang til celler og uavklart regulatorisk status er viktige utfordringer for slike preparater.
Abstract
Objective
To chart possible uses of drugs and drug preparations based on encapsulated cells, as well as important issues relating to such, with an emphasis on formulation.
Materials and methods
The articles and papers that underlie this article were collected during Den norske lægeforening’s Tissue Engineering Workshop, TERMIS World Conference 2009 in Seoul and with the help of ISI Web of Science.
Results
Preparations based on encapsulated cells are commonly used in the form of probiotics in human and veterinary medicine. Implants for human use have been under development for a long time.
Discussion
We point at four important challenges: Formulation, biocompatibility, access to cells and regulatory issues. Some of the most important challenges relating to implantable, cell-based therapies are those concerning the formulation of suitable gel matrices. Keywords in this respect are nutrient supply, biocompatibility and accommodation of specific cell types.
Conclusion
Cell-based, drug-like therapies currently have several uses in human and veterinary medicine. Future uses will follow from developments in materials technology and culture/differentiation methods.
Last ned hele artikkelen i pdf-format.
HENSIKT
En rekke sykdommer krever langtids- eller kronisk behandling med virkestoffer som er svært labile i et biologisk miljø, som i tilfellet Parkinsons sykdom og dopamin (Yasuhara og Date 2007). I andre tilfeller brukes virkestoffer som har en vanskelig syntese, men kan fremstilles relativt enkelt i cellekultur. Dette gjelder for eksempel veksthormoner ved hypofysesvikt. I noen tilfeller spiller begge deler inn, som for insulin og diabetes 1. Fremtidige behandlingsformer kan bli basert på kombinasjoner av biologiske faktorer som frisettes i et svært avgrenset område. Slik kan man stimulere cellene i vevet rundt til å endre adferd. For eksempel kan celler i skadet ryggmarg gjendanne nerveforbindelser; nytt muskelvev og nye blodkar kan dannes etter et hjerteinfarkt.
Bruk av innkapslede eller immobiliserte celler kan gi mulighet til å nå noen av disse målene. Innkapslede celler og cellebaserte preparater har også blitt fremmet som mulige alternativer i forbindelse med behandling av vevsskader, organsvikt eller medfødte anatomiske defekter.
Slike preparater har vist lovende resultater mot diabetes i in vivo- og kliniske studier (Soon-Shiong, Heintz et al. 1994; Orive, Hernández et al. 2003). Det er også vist effekt mot Parkinsons sykdom (Yasuhara, Shingo et al. 2005) og hemofili B (Wen, Vargas et al. 2006) i in vivo-modeller. Et annet anvendelsesområde er sårbehandling, der studier i mus har vist lovende resultater (Weng, Romanov et al. 2008). Prinsippstudier har vist at innkapslede celler kan produsere monoklonale antistoffer. Dette åpner for spennende muligheter blant annet i behandling av autoimmune sykdommer (Shirai, Hashimoto et al. 1987).
Innkapsling av humane celler til reparasjon av vev har fått mye oppmerksomhet de siste årene. Kombinert med stamcelleforskning knyttes det store håp til slik teknologi. Likevel er ideen om bruk av levende celler som legemiddel temmelig gammel, og ble først formulert av den russiske biologen og legen Metsjnikov i 1908 (Mečnikov 1988 (original 1908)). Han foreslo å bruke bakteriekulturer fra surmelk til stabilisering av tarmfloraen. Dette er det direkte opphavet til dagens probiotika (Vasiljevic og Shah 2008). Nyere forskning har vist at innkapslede E. coli-bakterier gitt peroralt gir god effekt i behandling av uremi hos rotter (Prakash og Chang 1996), og det er vist at andre arter, bl.a. Lactobacillus spp. kan være egnet (Chow, Liu et al. 2003). Probiotika anvendes også i dyrefôr og i akvakultur (Gillor, Etzion et al. 2008).
Figur 1 illustrerer bruk av innkapslede celler som legemidler. Cellenes funksjon spenner fra utskillelse av enkeltsubstanser til gjendannelse og erstatning av funksjonelt vev. Det er et betimelig spørsmål om implanterbare innretninger med celler bør kalles legemidler. Dette vil vi komme tilbake til nedenfor.
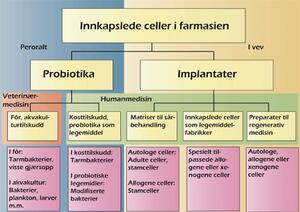
Figur 1. Oversikt over ulike anvendelser av innkapslede celler i farmasien, og hvilke typer celler som er aktuelle til disse formålene. Autologe celler er hentet fra pasienten selv. Allogene celler kommer fra andre individer av samme art. Xenogene celler stammer fra dyr, for eksempel gris.
RESULTATER OG DISKUSJON
Vi vil kort gjøre rede for utfordringer knyttet til den nåværende teknologien for cellebaserte preparater på fire områder, som vi mener er særlig sentrale: Formulering, biokompatibilitet, tilgang til celler og regulatoriske hensyn. En grafisk fremstilling av prinsippet for innkapsling av celler, med særlig vekt på de utfordringene som opptrer i forbindelse med implantater, finnes i figur 2.
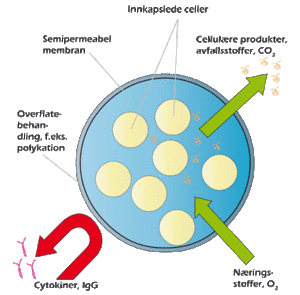
Figur 2. Prinsippskisse av et system der innkapslede celler produserer en gitt aktiv substans. Cellene er suspendert i en matrise, innesluttet av en semipermeabelmembran. Denne kan igjen være overflatebehandlet for å gi økt styrke eller bedre interaksjon med vev.
Formulering
Matriser og materialskjeletter må formuleres slik at de styrer cellenes adferd og beskytter cellene mot pasientens immunforsvar og enzymer. Det er viktig at diffusjon av næringsstoffer og virksomme produkter går raskt. Preparatet må brytes ned på en kontrollert måte og ikke avstøtes. Dagens teknologi er i hovedsak knyttet til to ulike konsepter: mikrokapsler og større matriser.
Mikrokapsler er særlig aktuelle der preparatet ikke skal ha en strukturell funksjon, og man bare er ute etter ett bestemt celleprodukt, for eksempel insulin. Slike kapsler fremstilles i hovedsak av alginat. De har en karakteristisk struktur, der høykonsentrert alginat utgjør en ytre, halvt gjennomtrengelig membran, som inneslutter en matrise av alginat i lavere konsentrasjon. Denne strukturen er et resultat av fremstillingsmåten: Alginatløsning dryppes kontrollert i et bad av divalente metallioner, for eksempel Ca2+ eller Sr2+. Dette fører til at det dannes en gel. På grunn av entropiske krefter vil alginatkonsentrasjonen være høyest ved overflaten, slik at man får en slags kapsel (Strand, Mørch et al. 2000).
Mikrokapsler har en diameter på under 1 mm, og inneholder derfor et begrenset antall celler. Hos mennesker overstiger avstanden fra en celle til nærmeste kapillær sjelden 200 µm. Den korte avstanden er direkte knyttet til cellenes behov for næring. Preparatets størrelse er derfor en viktig formuleringsfaktor.
For større preparater er det nødvendig enten å bruke lavere celletetthet, stimulere til dannelse av blodkar eller på annen måte sikre tilstrekkelig massetransport. I noen tilfeller kan vekslende mekanisk belastning ved bruk være tilstrekkelig. I mange tilfeller må man likevel formulere mer komplekse matriser, der enten struktur eller kjemi reduserer den effektive diffusjonsraten for viktige nærings- og avfallsstoffer. Oksygen er en særlig utfordring, på grunn av den lave vannløseligheten og det store behovet.
Nydannelse av blodkar i implantater er svært komplisert. De beste studiene begrenser seg foreløpig til in vivo-modeller uten immunforsvar (Jabbarzadeh, Starnes et al. 2008). Økt oksygentilgang ved hjelp av kjemiske modifikasjoner har vært forsøkt i in vitro-studier i form av gelemulsjoner med perfluorkarboner (Malda, Klein et al. 2007). Det er også mulig å tenke seg inkorporering av hem-baserte hjelpestoffer for å lette oksygendiffusjon.
For å øke de innkapslede cellenes levedyktighet bør innkapslingsmaterialets diffusjonsegenskaper, og hvordan ulike formuleringer påvirker disse, være godt kjent. Gode karakteristikker av de innkapslede cellenes metabolisme er åpenbart viktig. Gelmaterialenes porestørrelse må også tilpasses formålet. Liten porestørrelse vil føre til økt effektiv diffusjonslengde og redusert effektiv diffusjonsrate, samt utelukkelse av molekyler over en viss molekylvekt. Større porestørrelse vil gi økt næringstilgang og økt avsetning av cellulære produkter, men også i større grad eksponere cellene for immunsystemet. VEGF, en viktig vekstfaktor i nydanning av blodkar, har for eksempel en molekylradius på omkring 3,2 nm (Stefanini, Wu et al. 2008), mens det tilsvarende tallet for immunmediatoren IgG er 5,2 nm(Ambati, Canakis et al. 2000). For å beskytte mot IgG-medierte angrep på de innkapslede cellene må matrisen utformes slik at substanser med en molekylvekt over ca. 150 kDa eller diffusjonstverrsnitt over ca. 14 nm ikke kan diffundere inn (Striemer, Gaborski et al. 2006). Dette har åpenbart konsekvenser for formulering av matriser der en ønsker at det skal vokse blodkar. Porestørrelsen er en substansspesifikk egenskap og må tilpasses ved hjelp av monomerenes molekylvekt, kryssbindingsgrad og eventuelle øvrige gelkomponenter.
For større preparater er de biomekaniske egenskapene viktige: Viskoelastisiteten til gelmatrisen må avstemmes mot polymerkonsentrasjon og porestørrelse, samtidig som den påvirker preparatets evne til å motstå mekaniske belastninger på implantasjonsstedet. De innkapslede cellenes differensiering påvirkes også av de rheologiske egenskapene til innkapslingsmaterialet. Når det først påpekes, er det intuitivt lettfattelig at nerveceller trives bedre i myke geler som likner det plastiske nervevevet, mens korrekt differensiering av osteoblaster best foregår i stive geler (Weinand, Gupta et al. 2007). Økt stivhet oppnås ved å tilsette en større mengde kryssbinder per enhet av den geldannende polymeren og dermed øke kryssbindingsfrekvensen. Høyere kryssbindingsfrekvens vil imidlertid føre til sprøere geler. Den dynamiske bindingsmekanismen til alginater, basert på ionebindinger med relativt lav individuell bindingsenergi, gjør at alginater kan formuleres for å tilfredsstille en rekke ulike krav. En metode for å gi større mekanisk styrke som er blitt brukt både for større matriser og mikrokapsler av alginat går ut på å dekke yttersiden av preparatet med polykationiske polymere som poly-L-lysin og poly-L-ornitin (Schmidt, Rowley et al. 2008). Ettersom alginat er et polyanion binder disse seg tett til polymerskjelettet.
Et annet krysningspunkt mellom formuleringsvitenskap, celleinnkapsling og biokompatibilitet finner vi i bruken av erytrocytter som biologisk stabilisator for innkapslede ß-celler (Wiegand, Kroncke et al. 1993). Erytrocyttene fungerer som gatefeiere (scavengers) og nøytraliserer cytotoksiske nitrogenoksider som produseres av immunceller. Som analogi til den tradisjonelle formuleringsvitenskapens bruk av tilsatsstoffer eller andre strategier for å beskytte virkestoff ved å innstille optimal pH, hindre oksidasjon og gi økt fotostabilitet, peker denne bruken av cellulære eksipienter i retning av spennende muligheter for tverrfaglig forskning. Saminnkapsling av en eller flere celletyper med den primært terapeutiske kan i mange tilfeller være ønskelig og i visse tilfeller også nødvendig på grunn av for eksempel parakrine reguleringsprosesser. Det finnes imidlertid lite forskning på dette feltet i dag.
Preparater til peroral bruk vil stå overfor andre, men mer velkjente problemstillinger i forbindelse med å bringe levende celler gjennom magesekken og de øvre delene av tynntarmen. Mye av dagens probiotika er formulert uten spesifikk beskyttelse, blant annet er de aktive bakteriestammene i mange probiotiske produkter fritt suspendert i den gelen som utgjøres av denaturerte melke- eller korn(-lipo-) proteiner. Bakteriestammene som brukes i probiotika er i mange tilfeller anaerobe og doseringsformen må derfor formuleres med henblikk på å utelukke oksygen fra preparatet i størst mulig grad. I et vandig preparat med høy metabolsk aktivitet er imidlertid dette et trivielt problem.
Formulering av probiotiske preparater følger ellers i grove trekk de samme prinsippene som innkapslede mammalskeceller, og de fleste formuleringer hvor det probiotiske agens ikke er direkte suspendert i en matvare eller liknende baserer seg på mikroinnkapsling. Peroralt er tilfanget av polymermaterialer som kan brukes langt større enn for preparater som skal implanteres i vev. En oversiktsartikkel av Anal et al. (Anal og Singh 2007) nevner bl.a. karragenan, kitosan, alginat og ftalsyrederivater. Når perorale preparater i form av matvarer skal formuleres må det også tas hensyn til sanseopplevelsen ved inntak. I mange tilfeller vil dette føre til at større mikrokapsler er lite egnet, i visse tilfeller får man utfordringer når det gjelder smak og lukt.
Formulering av probiotika der bakteriestammen ikke er suspendert i et vandig medium kan være nyttig, ikke minst med tanke på å utvide spekteret av probiotiske doseringsformer utover meieriprodukter og forlenge holdbarheten til probiotiske preparater. Tørre doseringsformer, slik som pulvere, avhenger av at probiotiske agens tørkes på en skånsom måte for å oppnå godt produksjonsutbytte. Anal et al. (Anal og Singh 2007) gir også en oversikt over ulike tørkemetoder. Frysetørking er den mest skånsomme metoden, men er relativt dyrt. Den krever oppstykket produksjon, i motsetning til spraytørking som kan inngå i en helkontinuerlig produksjonslinje. Riktig valg av suspensjonsmedium øker utbyttet i produksjon av tørkede probiotiske mikroorganismer (Chavez og Ledeboer 2007).
Vaginale probiotika må i likhet med enterale formuleres på en måte som tar hensyn til de aktuelle bakteriestammenes optimale levekår, samtidig som de på lik linje med andre vaginale doseringsformer må unngå sjenerende rester, lukt etc.
Biokompatibilitet og biodegraderbarhet
Gode formuleringer er viktige for å oppnå biokompatible preparater. Det stilles strenge krav til råvarekvaliteten, særlig med tanke på kjemisk renhet. Ettersom preparatene skal være til stede i vev over lang tid er det være svært viktig at substansene som brukes ikke i seg selv er immunstimulerende.
Inflammasjon og fibroser rundt preparatet er en vesentlig utfordring. Immunreaksjoner oppstår ved at proteiner som adsorberes til matrisens overflate rekrutterer immunceller. Disse utskiller cytotoksiner som dreper innkapslede celler direkte. Immunresponsen kan føre til en negativ endring i kjemiske og mekaniske forhold rundt et implantat og redusere levetiden. Fibrotisk innkapsling representerer en alvorlig hindring for massetransport, særlig av makromolekylære produkter. Hovedstrategiene for å unngå dette er: innkapsling av celler i inerte hydrogeler, modifisering av gelmatrisens overflate med inerte molekyler, forankring av inerte molekyler i cellemembranen og kontrollert formulering av hydrogelens mikrostruktur.
Imidlertid rapporteres det fremdeles om manglende biokompatibilitet in vivo. Dette antas først og fremst å ha sammenheng med innkapslingsmaterialets renhet. Flere grupper har rapportert å ha produsert celleholdige preparater som ikke har fremkalt noen negativ reaksjon ved implantering (Zimmermann, Zimmermann et al. 2005). Som en allmenn løsning er det blitt foreslått en standardiseringskomité som overvåker de eksperimentelle prosedyrene på feltet inntil man får bukt med problemet (Orive, Hernández et al. 2003).
Når et celleholdig preparat skal tillate cellene å danne en erstatning for tapt eller manglende vev, er det nødvendig at matrise-/materialskjelettdelen av preparatet brytes ned i takt med cellenes vekst. Dette er særlig aktuelt ved sårbehandling eller behandling av brusk- ogbeindefekter (Peter, Miller et al. 1998). Optimalisering av evnen til slik nedbrytning – biodegraderbarhet – vil avhenge av det mekaniske miljøet et preparat er ment for (da Silva Soares 2008). Preparater der innkapslingsmaterialet skal være romfyllende og ha en viss mekanisk stabilitet vil trolig måtte skreddersys til hvert enkelt brukstilfelle. For preparater der hovedformålet er utskillelse av fysiologisk virksomme stoffer, vil ønsket biodegraderbarhet avhenge av behandlingens varighet, toleransen for de innkapslede cellene og implanteringsstedet. Mikrokapsler med insulinproduserende celler har forblitt intakte i bukhulen på mennesker i mer enn et år (Soon-Shiong, Heintz et al. 1994). Dette er mer enn tilstrekkelig for å sikre et slikt preparats levedyktighet fra et rent praktisk synspunkt.
Tilgang til celler
Tilstrekkelig tilgang til korrekt differensierte eller differensierbare celler er en vesentlig utfordring (Sun, Ma et al. 1996). I et klinisk forsøk der én pasient fikk implantert innkapslede Langerhans’ øyer brukte man bukspyttkjertler fra åtte donorer (Soon-Shiong, Heintz et al. 1994). Det er vanskelig å tro at en så donorintensiv behandlingsform kan bli alminnelig utbredt. I artikkelens del 2 vil sannsynlige cellekilder bli drøftet, her vil vi peke på en av de største utfordringene når det gjelder celletilgang: standardiserte og reproduserbare cellekulturer.
I utvikling av legemidler vil fullt ut karakteriserte cellekulturer med kjente og reproduserbare egenskaper være svært viktig. Dette innebærer en betydelig utfordring dersom cellematerialet som skal brukes kommer fra adult mammalsk vev. Det kan tenkes at det er mulig å underkaste donormateriale en form for standardisert forbehandling, men den enkleste måten å utelukke variabilitet på vil være å basere seg på immortaliserte cellekulturer som dyrkes på strengt standardisert vis og underkastes kontinuerlig kontroll av genekspresjonsmønster. I kliniske studier frem til nå har man i hovedsak sett bort fra problemstillingen, for i det hele tatt å utvikle praktiske løsninger på det overordnete medisinske problemet, eller man har basert seg på autologe celler.
Tilgang på celler til probiotiske preparater er ikke en utfordring på samme måte som for andre celleterapier. Det utføres imidlertid noe arbeid når det gjelder å finne og karakterisere nye bakteriestammer til probiotisk bruk, men hoveddelen av probiotika baserer seg på for lengst etablerte kulturer.
Regulatoriske hensyn
Det er mange regulatoriske vanskeligheter ved bruk av innkapslede celler som legemiddelform. Markedsførte probiotika til mennesker regnes i dag som kosttilskudd, og er dermed unntatt de kvalitetskrav som stilles til legemidler. Preparater ment til implantering vil åpenbart måtte vurderes strengere. Hvor skal grensene går mellom legemidler, medisinsk utstyr og transplantasjon? Dersom det er mulig å basere seg på én bestemt cellelinje, vil det være mulig å definere hele preparatet med celler som legemiddel. Dersom matrisen og et eventuelt materialskjelett er utformet på en måte som gjør at det påvirker vertens eller pasientens fysiologi, vil preparatet omfattes av den norske legemiddellovens definisjon av legemidler. Hele preparatet kan da karakteriseres som en kombinasjon av legemiddel og en transplantasjon. Om matrisen/materialskjelettet ikke i seg selv påvirker pasientens fysiologi er kanskje medisinsk utstyr, på linje med katetre og stenter, en mer dekkende beskrivelse.
Protokoller for fremstilling av alginat i klinisk kvalitet, innkapslingav Langerhanske øyer og implantering av de resulterende celleholdige mikrokapslene er blitt godkjent av det italienske legemiddelverket for fase 1-studier (Calafiore, Basta et al. 2006). Mindre omfattende enkeltstudier er gjennomført en rekke steder. Mangelen på et regulatorisk rammeverk som fremstår som tilstrekkelig enhetlig på tvers av landegrensene påvirker likevel mulighetene for å utforme studier som tillater sammenlikning av resultater mellom forskergrupper.
EU-reglene om avanserte behandlingsformer utgjør det overordnete regelverket for slike terapier (EU 2007). Preparatgodkjenning i EØS-området er for tiden delt mellom det europeiske legemiddelverket EMEA (bruksferdige preparater) og nasjonale myndigheter (sykehusfremstilte preparater til enkeltpasient) (Sanzenbacher 2009). Probiotika benyttes hovedsakelig til profylakse og stilles overfor svakere regulatoriske krav enn legemidler. Likevel er det vesentlig å ha gode retningslinjer for utvikling og bruk av slike preparater. FAO/WHO utarbeidet slike retningslinjer i 2002 (Reid 2005). Innenfor EØS-området dekkes de av direktivet som populært omtales som Matsminkedirektivet (EU 2006), og Mattilsynet er norsk regulatorisk myndighet.
KONKLUSJON
Cellebaserte preparater har en rekke mulige bruksområder: Som probiotika til forebygging og behandling av særlig mage-tarmproblemer hos mennesker, og for å gi bedre helse og utbytte blant produksjonsdyr i land- og havbruk. Det knyttes store håp til cellebaserte preparater til parenteral bruk hos mennesker. De terapeutiske mulighetene når det gjelder kroniske og medfødte sykdommer som diabetes 1 og Parkinsons sykdom, samt vevsskader som brannsår, ryggmargsbrudd og artrose er svært spennende. Imidlertid står man overfor betydelige utfordringer med hensyn til formulering, biokompatibilitet, tilgang til celler og det regulatoriske rammeverket.
I del 2 av artikkelen vil ulike celle- og materialtyper bli nærmere omtalt. Dessuten vil vi peke på noen av de første mulige kliniske bruksområdene.
Oppgitte interessekonflikter: Ingen
Litteratur
Ambati J, Canakis CS et al. (2000). "Diffusion of High Molecular Weight Compounds through Sclera." Investigative ophthalmology and visual science 41(5): 1181-1185.
Anal AK og Singh H (2007). "Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery." Trends in Food Science and Technology 18(5): 240-251.
Calafiore R, Basta G et al. (2006). "Standard Technical Procedures for Microencapsulation of Human Islets for Graft into Nonimmunosuppressed Patients With Type 1 Diabetes Mellitus." Transplantation proceedings 38(4): 1156-1157.
Chavez BE og Ledeboer AM (2007). "Drying of probiotics: Optimization of formulation and process to enhance storage survival." Drying Technology 25(7-8): 1193-1201.
Chow KM, Liu ZC et al. (2003). "Free and microencapsulated Lactobacillus and effects of metabolic induction on urea removal." Artificial Cells, Blood Substitutes and Immobilization Biotechnology 31(4): 425-434.
da Silva Soares J. (2008). Constitutive Modeling for Biodegradable Polymers for Application in Endovascular Stents. College Station, Texas A&M University. PhD: 320.
EU (2006). Regulation on nutrition and health claims made on foods. 1924/2006. E. Union. Brussels, European Union.
EU (2007). The Regulation on Advanced Therapies. 1394/2007. E. Union. Brussels, European Union: L 324/121-L 324/137.
Gillor O, Etzion A et al. (2008). "The dual role of bacteriocins as anti- andprobiotics." Applied microbiology and biotechnology 81(4): 591-606.
Jabbarzadeh E, Starnes T et al. (2008). "Induction of angiogenesis in tissue-engineered scaffolds designed for bone repair: A combined gene therapy–cell transplantation approach " Proceedings of the National Academy of Sciences of the United States of America 105(32): 11099-11104.
Malda J, Klein TJ et al. (2007). "The Roles of Hypoxia in the In Vitro Engineering of Tissues." Tissue Engineering 13(9): 2153-2162.
Mečnikov II, Ed. (1988 (original 1908)). Etjudy optimizma. Moscow, Izdatel`stvo «Nauka».
Orive G, Hernández RM et al. (2003). "Cell encapsulation: Promise and progress." Nature Medicine 9(1): 104-107.
Peter SJ, Miller MJ et al. (1998). "Polymer Concepts in Tissue Engineering." Journal of Biomedical Materials Research 43(4): 422-427.
Prakash S og Chang TMS (1996). "Microencapsulated genetically engineered live E-coli DH5 cells administered orally to maintain normal plasma urea level in uremic rats." Nature Medicine 2(8): 883-887.
Reid G (2005). "The importance of guidelines in the development and application of probiotics." Current Pharmaceutical Design 11(1): 11-16.
Sanzenbacher R (2009). Regenerative Therapies - Regulatory Challenges from the Perspective of the German Regulatory Authority. TERMIS 2009 World Congress. Y. Son. Seoul, TERMIS. 2: 561.
Schmidt JJ, Rowley J et al. (2008). "Hydrogels used for cell-based drug delivery." Journal of Biomedical Materials Research Part A 87A(4): 1113-1122.
Shirai Y, Hashimoto K et al. (1987). "Continuous production of monoclonal antibody with immobilized hybridoma cells in an expanded bed fermentor." Applied microbiology and biotechnology 26(6): 495-499.
Soon-Shiong P, Heintz RE et al. (1994). "Insulin independence in a type 1 diabetic patient after encapsulated islet transplantation." The Lancet 343(8902): 950-951.
Stefanini, M. O., F. T. H. Wu, et al. (2008). "A compartment model of VEGF distribution in blood, healthy and diseased tissues." BMC Systems Biology.
Strand BL, Mørch YA et al. (2000). "Alginate as immobilization matrix for cells." Minerva Biotecnologica 12(4): 223-233.
Striemer CC, Gaborski TR et al. (2006). "Charge- and size-based separation of macromolecules using ultrathin silicon membranes." Nature 445(7129): 749-753.
Sun Y, Ma X et al. (1996). "Normalization of Diabetes in Spontaneously Diabetic Cynomologus Monkeys by Xenografts of Microencapsulated Porcine Islets without Immunosuppression." The Journal of Clinical Investigation 98(6): 1417-1422.
Vasiljevic T og Shah NP (2008). "Probiotics — From Metchnikoff to bioactives." International Dairy Journal 18(7): 714-728.
Weinand C, Gupta R et al. (2007). "Comparison of hydrogels in the in vivo formation of tissue-engineered bone using mesenchymal stem cells and beta-tricalcium phosphate." Tissue Engineering 13(4): 757-765.
Wen JW, Vargas AG et al. (2006). "Sustained and therapeutic levels of human factor IX in hemophilia B mice implanted with microcapsules: key role of encapsulated cells." The Journal of Gene Medicine 8(3): 362-369.
Weng L, Romanov A et al. (2008). "Non-cytotoxic, in situ gelable hydrogels composed of N-carboxyethyl chitosan and oxidized dextran." Biomaterials 29(29): 3905-3913.
Wiegand F, Kroncke KD et al. (1993). "Macrophage-Generated Nitric-Oxide as Cytotoxic Factor in Destruction of Alginate-Encapsulated Islets - Protection of Arginine Analogs and/or Coencapsulated Erythrocytes." Transplantation 56(5): 1206-1212.
Yasuhara T og Date I (2007). "Intracerebral transplantation of genetically engineered cells for Parkinson`s disease: Toward clinical application." Cell Transplantation 16(2): 125-132.
Yasuhara, T., T. Shingo, et al. (2005). "Neurorescue effects of VEGF on a rat model of Parkinson`s disease." BrainResearch 1053(1-2): 10-18.
Zimmermann H, Zimmermann D et al. (2005). "Towards a medically approved technology for alginate-based microcapsules allowing long-term immunoisolated transplantation." Journal of Materials Science-Materials in Medicine 16: 491-501.
Manuskriptet ble mottatt 3. mars 2009 og godkjent 23. september 2009.
Fagredaktør Ingunn Tho.
Norsk Farmaceutisk Tidsskrift 2009; 11: 22–5.
