Innkapslede celler som legemiddelform, del 2
Sammendrag
Hensikt
Å gå gjennom celletyper, materialer og muligheter for teknologier hvor innkapslede celler blir brukt som legemidler, eller til nært beslektede formål.
Materialer og metoder
Bakgrunnsmaterialet er innhentet fra bidrag på Tissue Engineering workshop 2.–3. juni 2008 i regi av Den norske legeforening, TERMIS World Conference 2009 i Seoul, samt ved hjelp av databasen ISI Web of Science.
Resultater
Ved bruk av innkapslede celler som legemidler eller i legemiddelliknende preparater er det vesentlig at valg av celletype er tilpasset formål og innkapslingsteknologi. Hydrogeler fremstilt av alginat eller polyetylenglykol utpeker seg som de mest egnede bærersubstansene.
Diskusjon
Preparater basert på mikroorganismer finnes allerede i rikt monn i form av probiotika. For flere formål er det betydelige vansker knyttet til de tilgjengelige celletypene. Materialvalg bestemmes av krav til biotilgjengelighet og spiller også en vesentlig rolle i styring av de innkapslede cellenes funksjon.
Konklusjon
Cellebaserte terapier har i dag flere bruksområder innenfor human- og veterinærmedisin. For implantater til human bruk er tilgang til trygge celler for øyeblikket et betydelig hinder for klinisk anvendelse.
Hovedbudskap
Innkapslede celler som implanterbare legemidler er en mulig løsning på flere medisinske problemer.
Ved bruk av innkapslede celler som legemidler er valg av celletype og innkapslingsmateriale helt vesentlig.
Det er i dag betydelige utfordringer knyttet til forsyning med tilstrekkelige mengder trygge celler.
Abstract
Objective
To survey cell types, materials and possibilities for technologies that employ encapsulated cells as drugs or for drug-like purposes.
Materials and methods
The articles and papers that underlie this article were collected during Den norske lægeforening’s Tissue Engineering Workshop, TERMIS World Conference 2009 in Seoul and with the help of ISI Web of Science.
Results
When using encapsulated cells in drug-like appliances it is crucial that the cell type used is suitable to the purpose and encapsulation technology used. Alginate and PEG hydrogels stand out as highly suitable carriers.
Discussion
Preparations based on microorganisms are currently widely available in the form of probiotics. For many purposes, the available cell types face significant challenges. The choice of materials is decided by demands on bioavailability and plays a crucial role in the control of cell function.
Conclusion
Cell-based, drug-like therapies currently have several uses in human and veterinary medicine. Clinical availability of implants for human use is hampered by the lack of safe cell sources.
Last ned hele artikkelen i pdf-format.
HENSIKT
I første del av denne artikkelen (publisert i NFT nr. 11/2009) ble status og viktige utfordringer knyttet til bruk av innkapslede celler som legemiddelform gjennomgått. I den andre delen av artikkelen vil vi kort gjøre rede for overordnede kategorier av celler og materialer som er aktuelle for slike formål, og avslutningsvis skissere noen muligheter for fremtidig forskning og bruk.
Når man skal utvikle cellebaserte terapier er valg av celler helt sentralt. Den ideelle cellen ville kunne dyrkes kontinuerlig og dele seg uendelig mange ganger, ha evne til å differensiere til en hvilken som helst adult celle under nøye karakteriserbare betingelser og være fullt ut kompatibel med enhver verts immunsystem. En slik celle finnes naturligvis ikke. Vi vil gå gjennom ulike cellekilder og peke på fordeler og ulemper knyttet til dem.
En rekke ulike materialer er blitt foreslått og utprøvd som innkapslingsmateriale. Hovedvekten av forskningen konsentrerer seg imidlertid om et lite utvalg polymere. Vi vil presentere de viktigste egenskapene til ett av disse materialene, alginat, og drøfte noen generelle betraktninger knyttet til valg av materiale.
RESULTATER
Generelt
Viktige suksessfaktorer for bruk av ulike celler er hvor mange passasjer de kan dyrkes i (ekspansjonsevne), forholdet vert-donor og for stamceller det mangfold av celletyper de kan gi opphav til (potensitet). Ekspansjonsevne er vesentlig for å dyrke store kvanta. Vert-donor-forholdet har betydning for en eventuell immunreaksjon. Celler kan kategoriseres som autologe, allogene eller xenogene. Autologe celler kommer fra pasienten selv og gir ingen grunn til å forvente en immunreaksjon. Allogene celler kommer fra et fremmed individ av samme art og fører til velkjent avstøtningsproblematikk. Xenogene celler kommer fra en annen art, for eksempel gris, og gir i tillegg til fare for avstøtning bekymringer knyttet til trygghet. Det finnes i dag protokoller for differensiering av en rekke stamcelletyper fra et definert utgangspunkt. Nylig har betydningen av ikke bare biokjemiske, men også biomekaniske dyrkingsforhold fått større oppmerksomhet. Ulike celletypers potensitet drøftes kort i avsnittene nedenfor.
Brukes celler som ikke er spesielt modifisert eller i utgangspunktet egner seg for isolert dyrking, vil man måtte ta hensyn til samspillet mellom ulike celletyper i naturlig vev. Som nevnt i del 1 kan man se kombinasjonen av ulike celler i samme preparat analogt med bruk av tilsatsstoffer i konvensjonelle preparater. I forbindelse med bruk av visse typer nerveceller vil man for eksempel vanskelig unngå å inkludere astrocytter, mens det i andre tilfeller, slik som med ß-celler fra Langerhanske øyer kan være sentralt å sikre streng rensing for å hindre kontaminering med kanalceller som i naturlig vev er nært assosiert med disse (Pavlovic, Chen et al. 1999).
Cellelinjer til perorale og enterale preparater
Melkesyrekulturer har fra begynnelsen av vært bærebjelken for perorale probiotika. Den moderne WHO-definisjonen av probiotika innebærer at mange ulike bakteriestammer kan regnes som probiotiske, men melkesyrebakterier forblir den kommersielt viktigste typen (Vasiljevic og Shah 2008). Gillor et al. har nylig publisert en oversikt over mikroorganismer som er i bruk eller vurderes tatt i bruk i probiotiske preparater (Gillor, Etzion et al. 2008). Lactobacillales og Bifidobacteriales er de viktigste ordenene.
Behandling av tarmlidelser ved hjelp av bakteriekulturer fra familiemedlemmers avføring (Gustafsson, Lund-Tønnesen et al. 1998) er i rutinemessig bruk ved norske sykehus. Denne kilden er åpenbart uspesifikk ogvil gi store interindividuelle variasjoner. Likevel er dette et eksempel på den typen valg som gjør seg gjeldende når det gjelder bruk av celler i terapi generelt: valg mellom praktisk tilgjengelighet og mulighet for standardisering.
Stamceller
Det knyttes store forhåpninger til bruk av stamceller i celleterapi og i det beslektede feltet regenerativ medisin. Den stamcelletypen som har fått mest medieoppmerksomhet er utvilsomt embryonale stamceller (ESC), som hentes fra blastocyster (Thomson, Itskovitz-Eldor et al. 1998). Embryoniske stamceller er i stand til å differensiere til en hvilken som helst celletype som finnes i voksne individer. Imidlertid har forskning på ESCer foreløpig ikke gitt de ønskede resultatene, og det gjenstår fremdeles bekymringer for trygghet, bl.a. når det gjelder ESCenes tendens til å vokse ukontrollert og danne teratomer (Dressel, Schindehutte et al. 2008).
Det arbeides med en rekke andre kilder til humane stamceller: stamceller fra fostervann, navlestrengsblod og mesenchymale stamceller. Fostervannsceller er spesielt interessante, siden de kan dyrkes uendelig og har høy potensitet (De Coppi, Bartsch et al. 2007). Bruk av stamceller fra navlestrengsblod blir begrenset av nettopp begrenset ekspansjonsevne. Det er blitt foreslått å opprette en stamcellebank av fostervannsstamceller, som skal kunne gi grunnlagsmateriale til behandling av 99 prosent av alle individer i USA med utgangspunkt i 100 000 vevstypede donorer (Atala 2008). Mesenchymale stamceller fra beinmarg eller fettvev har mindre potensitet enn stamceller fra fostervann, men kan høstes fra den enkelte pasient.
Cellelinjer og xenogene celler
Det finnes flere etablerte cellelinjer til spesifikke forskningsformål, slik som beta-insulinom-celler fra mus, brukt som modeller i arbeid med innkapslede celler til diabetesbehandling. Klinisk bruk av slike celler er foreløpig hemmet av fare for avstøtning og frykt for dannelse av ondartede svulster. For xenogene celler må sannsynligheten for immunreaksjon forventes å øke og kvalitetskontrollen må være grundigere. Det er viktig å sikre at ikke latente virus krysser artsbarrierer når potensielt smittebærende, innkapslede celler implanteres i vev.
En annen mulighet er å overstyre cellenes eget system for aldersregulering, slik at voksne celler kan dyrkes og ekspanderes in vitro. En prosedyre for hvordan dette kan gjøres er nylig blitt publisert (Kobayashi 2008). Imidlertid vil det kreves en betydelig forskningsinnsats før celler fra slike kilder blir ansett som trygge og oppnår regulatorisk godkjenning som del av legemidler.
Autologe celler
På kortere sikt er det mer sannsynlig at celleholdige preparater vil basere seg på celler hentet fra pasienten selv. Autotransplantasjon er allerede rutine i brannskadebehandling, og enkelte forskergrupper driver i dag utstrakte kliniske forsøk med mer komplekse preparater basert på pasientbiopsier (Auger 2006). Tilsvarende kan man se for seg bruk av autologe celler til rekonstruksjon av tubulære, muskulære organer, slik som vagina og urinrør. Celler fra biopsier dyrkes opp og ekspanderes, og sås deretter tilbake på et decellularisert materialskjelett av bindevev, med eller uten tillegg av en mekanisk strukturerende matrise. Slike applikasjoner ligger nok nærmere definisjonen av medisinsk utstyr enn egentlige legemidler, men den fysikalsk-kjemiske interaksjonen mellom materialskjelett og celler er trolig vesentlig for å oppnå et godt resultat (Atala 2008).
Materialer: Matriser og materialskjeletter
Alginat er det overlegent vanligste materialet tilmikroinnkapsling av levende celler, på grunn av de fordelaktige geldanningsegenskapene som tillater direkte innkapsling av levende celler uten at de skades (Strand, Mørch et al. 2000). Alginat er en biopolymer som består av 1→4-bundet α-L-guluronsyre og ß-D-mannuronsyre. Mikroinnkapsling foregår som regel ved hjelp av et apparat der en kontinuerlig strøm av alginatløsning med suspenderte celler brytes av fra en dyse ved hjelp av en koaksial luftstrøm eller et elektrostatisk potensial. De homogent størrelsesfordelte alginatdråpene faller ned i et kar med en løsning av polyvalente metallioner, som regel Ca2+, Sr2+ eller Ba2+. Dette gir parvis kryssbinding mellom de lineære alginatmolekylene og det dannes en gel (Strand, Mørch et al. 2000), se figur 1. Mikrokapslene kan etterbehandles med polykationer som poly-L-lysin eller poly-L-ornitin for økt mekanisk styrke og kontroll av porestørrelse. Det er i så fall også vanlig å gjennomføre en ytterligere etterbehandling med alginat, slik at den endelige kapselstrukturen blir alginat-polykation-alginat.
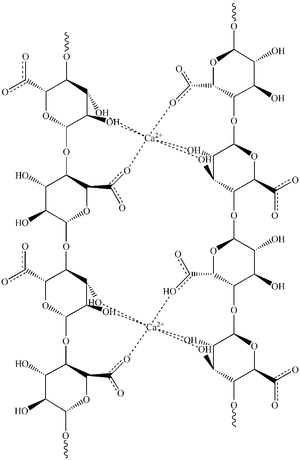
Figur 1. Kryssbundet alginat. Ca2+-ioner koordinerer OH- og COOH-grupper i konsekutive α-L-guluronsyre-blokker i polymerstrukturen når to slike blokker finnes i parallelle alginatkjeder.
In vitro er Polyetylenglykol (PEG) og alginat blant de viktigste polymermaterialene til immobilisering av celler i større matriser. Noen andre gelformuleringer, bl.a. kollagenderivater, kitosan og hyaluronsyre er hyppig brukte biologisk fremstilte materialer. På den syntetiske siden er det et større mangfold. Bortsett fra PEG er polylaktid (PLL), polykaprolakton (PCL) og polyglykolid (PGL), samt kopolymerer av disse, vanlige. Schmidt et al. (Schmidt, Rowley et al. 2008) oppsummerer kliniske eller prekliniske forsøk med innkapslede celler og dokumenterer at alginat er den mest brukte matrisen, med PEG på andre plass. Polyetersulfon, hyaluronsyre og hydroksyetylmetakrylat (HEMA) nevnes én gang hver.
Matriser og materialskjeletter til bruk i regenerativ medisin har vanligvis en todelt struktur. Et materialskjelett gir preparatet form og cellene forankring. En gelmatrise utenpå dette gir immunbeskyttelse og styrer diffusjon inn og ut av preparatet. Matrisematerialet må ha veldefinerte hydrofobe, hydrofile og elektrostatiske interaksjoner. Forholdet mellom gelnettverkets porestørrelse og effektiv diffusjonsvei er viktig. Porestørrelsen avgjør dessuten molekylvektgrense for diffusjon i matrisen. Som nevnt vil preparatets viskoelastiske egenskaper påvirke cellenes fenotype og funksjon.
Forankring for cellene og interaksjon med matriksproteiner er viktig for å oppnå ønskede mekaniske egenskaper, men spiller også en rolle når det gjelder differensiering av celler (Okano 2009). Vellykket konstruksjon av cellebaserte implantater krever definerte material-celleinteraksjoner. I noen tilfeller har decellularisert bindevev, eller også hele bindevevsstrukturer fra organer der det opprinnelige cellematerialet er fjernet vært brukt som materialskjelett. Dette fører til at forankringsmotiver i bindevevet, for eksempel kollagenbundede peptider, som tjener som festepunkt for integriner også er intakt. Ved bruk av syntetiske materialskjeletter finnes det ingen naturlige festepunkter for cellene, og integrinligander (stort sett nokså korte oligopeptider) må bindes kovalent tilmaterialskjelettets eller matrisens polymere. RGD-peptidet (arginin-glysin-aspartat) har vært mye brukt, men nyere forskning tyder på at dette peptidet er uspesifikt, og at det i naturlig vev finnes vevsspesifikke integrinligander som bl.a. styrer differensiering av cellene. En slik ligand er vist å fremme dannelsen av beinvev i titanimplantater (Reyes, Petrie et al. 2007). I tillegg kan adsorpsjon av løste proteiner og deponering av cellenes egne produkter på matrisen og materialskjelettet mediere sterkere kontakt mellom cellene og resten av preparatet (Garcia 2005).
DISKUSJON
Praktiske hensyn
Når de regulatoriske hindringene for markedsføring av cellebaserte preparater er overvunnet, vil sannsynligvis de første cellebaserte produktene bestå av innkapslede insulinproduserende celler med intakt reguleringssystem. Dette vil være et betydelig fremskritt i forhold til dagens behandlingsalternativer, både i forhold til klinisk utbytte, komfort og compliance. De første preparatene vil trolig være avhengige av å byttes ut med jevne mellomrom, men in vivo-studier har så langt vist at det er mulig å holde innkapslede Langerhans’ øyer i live og funksjonelle i over et år (Soon-Shiong, Heintz et al. 1994). Innkapslingsmaterialene er nå velprøvde. Et produkt som skal markedsføres i stor stil vil oppnå en fordel ved å basere seg på en immortalisert cellelinje, ettersom dette vil lette tilgangen til celler.
Kliniske anvendelser
Probiotika
Utviklingen av funksjonelle matvarer (Doyon og Labrecque 2008) kan gi rom for en betydelig vekst i bruken av perorale probiotika. Sammen med trender i retning av redusert aksept for bruk av antibiotika i akvakultur og landbruk peker dette i retning av en betydelig vekst for feltet som helhet. De senere årene har tilbudet av probiotiske preparater til peroral bruk hos mennesker økt betydelig, og i tillegg til gamle og veletablerte preparater som Idoform® er det kommet et rikt utvalg av særlig meieriprodukter med probiotiske egenskaper. Birkeland og Tandberg har skrevet en innføring om probiotiske meieriprodukter i Tidsskrift for Den norske legeforening (Birkeland og Tandberg 2003).
Til stabilisering av vaginal mikroflora finnes det allerede i dag flere formuleringer og preparater med melkesyrebakterier, slik som tamponger (Ellen®), kremer og vagitorier (bl.a. Vivag®, Ecovag®). Det gjenstår imidlertid å påvise varig effekt av slike behandlinger (Barrons og Tassone 2008). Nylig er også probiotiske preparater for forebygging av karies kommet på markedet (G.U.M.®). Effekten av probiotika i reduksjon av karies-fremkallende Streptococcus mutans er påvist i kliniske studier (Caglar, Kuscu et al. 2008). Forskning på probiotiske preparater har også vist lovende resultater i behandling av periodontitt (Persson 2005).
I veterinærmedisin og akvakultur brukes probiotika til behandling og forebygging av helseplager hos produksjonsdyr, og tilsettes ofte i fôr. I akvakulturen omgir opportunistiske patogener vertsdyr hele tiden, mens patogen-reservoarer hos landdyr i hovedsak er begrenset til GI-tractus og øre-nese-hals-komplekset. Derfor opererer man med et utvidet probiotika-begrep i akvakultur, som også omfatter mikroorganismer som påvirker miljøet produksjonsdyrene lever i. I referansene finnes oversiktsartikler som dokumenterer den vide bruken av probiotika i veterinærmedisin og akvakultur (Verschuere, Rombaut et al. 2000; Ghadban 2002; Chaucheyras-Durand, Walker et al. 2008; Wang, Li et al. 2008).
Kroniske lidelser
I tillegg til innkapslede insulinseccernerende celler i behandling av diabetes, er det nærliggende å se for seg bruk av innkapslede celler i administrering av monoklonale antistoff for behandling av bindevevssykdommer. I disse tilfellene produseres virkestoffet allerede biologisk, det kreves relativt hyppig administrasjon som involverer injeksjon og preparatene er svært dyre. Alle disse faktorene styrker potensialet til implantater med innkapslede celler.
Det er gjennomført en rekke studier med innkapslede insulinproduserende celler mot diabetes, men det har foreløpig ikke lykkes å utvikle en behandling som er tilstrekkelig standardisert eller kostnadseffektiv til å gjøres allment tilgjengelig. Det forskes intenst på feltet, men basert på erfaringene fra utviklingen så langt er det vanskelig å spå når en slik behandling vil bli markedsført.
Det vies også mye oppmerksomhet til forskning på celleterapier i forbindelse med artrose og beindefekter. Disse vevstypene er enklere å håndtere, bl.a. på grunn av lavere celletetthet og mindre cellulær diversitet. I forskning på disse områdene av regenerativ medisin brukes oftere adulte celler som ekspanderes fra et utgangspunkt som ikke er større en at pasienten selv kan stå som donor. Disse forholdene vil gjøre det lettere å utvikle standardiserte behandlinger som egner seg for allmenngjøring med dagens teknologi.
Sårbehandling
En del forskningsgrupper har arbeidet med rent cellebaserte terapier ved sårbehandling, noen av disse i regi av Laboratoire d’Organogénèse Expérimentale (LOEX), ved Hôpital du Saint-Sacrement i Quebec. Man har særlig konsentrert seg om epitelvev, blant annet hud og hornhinner. En slik tilnærming har mange positive trekk, blant annet utelukkende bruk av pasientens egne celler, slik at det ikke vil oppstå problemer med avstøtning eller immunreaksjoner. Det er også en åpenbar fordel at man under rekonstruksjon av vev benytter cellenes egen evne til organisering og forming av vevets mekaniske egenskaper. Imidlertid er en slik tilnærming meget arbeidsintensiv og tidkrevende (Auger 2006). I akutte situasjoner, som for eksempel i forbindelse med brannskader og liknende, vil dette legge begrensninger på slike terapier. Det kan da være aktuelt med enten polymerbaserte preparater med lavere celletetthet, basert på pasientens egne celler, eller med allotransplanterte celler, for eksempel AFS-celler, i høyere tetthet. Man bruker allerede alginatbaserte kompresser i behandling av brannskader: Det er ikke vanskelig å tenke seg at hydrogelbaserte kompresser basert på denne eller andre polymere kan designes med en gradient av vekst- og differensieringsfaktorer, inokuleres med stamceller før bruk og dermed styre disse til dannelse av nytt vev.
Avanserte formuleringer og bruksområder
Bruk av vekstfaktorgradienter har vist seg å være nyttig in vivo for å styre nydannelse av nerver (Dodla og Bellamkonda 2008). Slike avanserte formuleringer, der preparatene har prefabrikerte gradienter av ulike signalstoffer, vil trolig bli vanlige i celleholdige preparater, der målet ikke bare er å forsyne pasienten med et hormon eller reparere en begrenset defekt i et vev, men å gjendanne komplekse vev eller større nerver. Lokal blodkars- og lymfekarsdannelse, samt lokal innervering kan skje in vivo hos kaniner uten andre eksterne stimuli enn et decullarisert bindevevsskjelett (De Philippo, Bishop et al. 2008). Et viktig formuleringsprinsipp som kan bli tatt i bruk i økende grad, etter hvert somteknologien tillater det er biomimetikk. Biomimetiske formuleringer tar utgangspunkt i in vivo-forhold og forsøker å gjenskape hovedtrekkene i en gitt biologisk struktur i formuleringen av et preparat. Innebygde vekstfaktorgradienter, etterligning av ekstracellulær matrix og bindevevsstruktur, samt tilpasning av biomekaniske egenskaper, kan sammen utgjøre en helhetlig biomimetisk strategi. Nanoteknologi kan i denne sammenhengen bli viktig, for eksempel ved å tillate lag-for-lag-deponering av matriser med styrt struktur og gradienter av signalstoffer (Tang, Wang et al. 2006).
Sammenliknet med volumet av forskning på øvrige celleterapier, er det gjort lite for å utforske innkapslede celler som leveringsvektor for lokalt virkende substanser. Dette kan likevel bli en av de viktigste anvendelsene på sikt, ettersom en av styrkene til innkapslede celler er produksjon av biologisk labile stoffer med begrenset evne til å transporteres over større avstander in vivo. I en slik sammenheng kan man se for seg et vidt spekter av anvendelsesområder fra leveranse av apoptose-induktive cytokiner proksimalt til kreftsvulster til mikrokapsler med celler som produserer monoklonale antistoff i hardt rammede ledd ved revmatisme.
KONKLUSJONER
I denne artikkelen har vi drøftet farmasøytisk anvendelse av levende celler innkapslet eller immobilisert i ulike materialer. Viktige skiller går mellom preparater der cellenes primære funksjon er å påvirke pasientens bakterieflora, erstatte en bestemt fysiologisk funksjon og/eller (ny)danne vev. Celler til legemidler eller legemiddelliknende preparater som skal implanteres, kan hentes fra flere ulike kilder: Pasienten selv, andre humane donorer eller fra dyr. Celler fra pasienten selv er trygge, men ofte vanskelig å fremskaffe i tilstrekkelig antall. Celler fra donorer gir utfordringer når det gjelder avstøtning, mens de celletypene som i dag er tilgjengelige i ubegrenset mengde foreløpig ikke anses trygge til klinisk bruk. Disse skillene fører til ulike valg og muligheter med tanke på videre forskning og formulering.
Det finnes allerede en rekke preparater til human- og veterinærmedisinsk bruk som endrer bakteriefloraen, spesielt i GI-tractus. Disse bruker i hovedsak tradisjonell formuleringsteknologi.
Oppgitte interessekonflikter: Ingen
Litteratur
- Atala A (2008). Amniotic Fluid and Placental Stem Cells. Tissue Engineering-workshop i regi av Den norske legeforening. Soria Moria konferansesenter, Oslo, Norway.
- Atala A (2008). Tissue engineering using acellular and cell seeded biomaterials. Tissue Engineering-workshop i regi av Den norske legeforening. Soria Moria konferansesenter, Oslo, Norway.
- Auger FA (2006). «The LOEX Perspective on the Role of Tissue Engineering in Regenerative Medicine.» Bio-Medical Materials and Engineering 16(4): S19–S25.
- Barrons R og Tassone D (2008). «Use of Lactobacillus probiotics for bacterial genitourinary infections in women: A review.» Clinical Therapeutics 30(3): 453–468.
- Birkeland SE og Tandberg A (2003). «Kan probiotiske melkesyrebakterier fremme helsen?» Tidsskrift for den norske lægeforening 123(12): 1701–1703.
- Caglar E, Kuscu OO et al. (2008). «A probiotic lozenge administered medical device and its effect on salivary mutans streptococci andlactobacilli.» International Journal of Pediatric Dentistry 18(1): 35–39.
- Chaucheyras-Durand F, Walker ND et al. (2008). «Effects of active dry yeasts on the rumen microbial ecosystem: Past, present and future.» Animal Feed Science and Technology 145(1–4): 5–26.
- De Coppi P, Bartsch Jr. G et al. (2007). «Isolation of amniotic stem cell lines with potential for therapy.» Nature Biotechnology 25(1): 100–106.
- De Philippo RE, Bishop CE et al. (2008). «Tissue engineering a complete vaginal replacement from a small biopsy of autologous tissue.» Transplantation 86(2): 208–214.
- Dodla, MC og Bellamkonda RV (2008). «Differences between the effect of anisotropic and isotropic laminin and nerve growth factor presenting scaffolds on nerve regeneration across long peripheral nerve gaps.» Biomaterials 29(1): 33–46.
- Doyon M og Labrecque J (2008). «Functional foods: a conceptual definition.» British Food Journal 110(10-11): 1133–1149.
- Dressel R, Schindehutte J et al. (2008). «The tumorigenicity of mouse embryonic stem cells and in vitro differentiated neuronal cells is controlled by the recipients` immune response.» PLoS ONE 3(7): e2622.
- Garcia AJ (2005). «Get a grip: integrins in cell-biomaterial interactions.» Biomaterials 26(36): 7525–7529.
- Ghadban GS (2002). «Probiotics in broiler production – a review.» Archiv für Geflügelkunde 66(2): 49–58.
- Gillor O, Etzion A et al. (2008). «The dual role of bacteriocins as anti- and probiotics.» Applied microbiology and biotechnology 81(4): 591–606.
- Gustafsson A, Lund-Tønnesen S et al. (1998). «Faecal short-chain fatty acids in patients with antibiotic-associated diarrhoea, before and after faecal enema treatment.» Scandinavian Journal of Gastroenterology 33(7): 721–727.
- Kobayashi N (2008). «Artificial cells for the development of cell therapy.» Cell Transplantation 17(1–2): 3–9.
- Okano T (2009). Clinical Application of Cell Sheet Tissue Engineering and Future Perspectives. TERMIS 2nd World Congress 2009. Seoul, South Korea, TERMIS.
- Pavlovic D, Chen MC et al. (1999). «Contribution of ductal cells to cytokine responses by human pancreatic islets.» Diabetes 48(1): 29–33.
- Persson GR (2005). «Immune responses and vaccination against periodontal infections.» Journal of Clinical Periodontology 32(Suppl. 6): 39–53.
- Reyes CD, Petrie TA et al. (2007). «Biomolecular surface coating to enhance orthopaedic tissue healing and integration.» Biomaterials 28(21): 3228–3235.
- Schmidt JJ, Rowley J et al. (2008). «Hydrogels used for cell-based drug delivery.» Journal of Biomedical Materials Research Part A 87A(4): 1113–1122.
- Soon-Shiong P, Heintz RE et al. (1994). «Insulin independence in a type 1 diabetic patient after encapsulated islet transplantation.» The Lancet 343(8902): 950–951.
- Strand BL, Mørch YA et al. (2000). «Alginate as immobilization matrix for cells.» Minerva Biotecnologica 12(4): 223–233.
- Tang Z, Wang Y et al. (2006). «Biomedical applications of layer-by-layer assembly: From biomimetics to tissue engineering.» Advanced Materials 18(24): 3203-3224.
- Thomson JA, Itskovitz-Eldor J et al. (1998). «Embryonic stem cell lines derived from human blastocysts.» Science 282(5391): 1145–1147.
- Vasiljevic T og Shah NP (2008). «Probiotics — From Metchnikoff to bioactives.» International Dairy Journal 18(7): 714–728.
- Verschuere L, Rombaut G et al. (2000). «Probiotic bacteria asbiological control agents in aquaculture.« Microbiology and Molecular Biology Reviews 64(4): 655-+.
- Wang YB, Li JR et al. (2008). «Probiotics in aquaculture: Challenges and outlook.» Aquaculture 281(1–4): 1–4.
Manuskriptet ble mottatt 3. mars 2009 og godkjent 23. september 2009. Fagredaktør Ingunn Tho.
Norsk Farmaceutisk Tidsskrift 2009; 12: 38–41.
