Mikrobiell kartlegging av medisinrom ved St. Olavs Hospital

Hovedbudskap
Kartleggingen avdekker varierende og til dels betydelige mengder mikroorganismer i luft og på overflater i medisinrommene som ble undersøkt.
Sterile legemidler utsettes for potensiell mikrobiell kontaminasjon ved at de blandes ut på medisinrom i institusjoner.
Både å tilsette legemidler fra ampulle og å injisere luft i hetteglass for å kompensere for trykkforskjeller vil eksponere legemidler for mikrober i luft.
Dette gjøres på tross av at Norske legemiddelstandarder (NLS) anbefaler at «tilsetning til infusjonsvæsker som gir gode vekstbetingelser for mikroorganismer, som for eksempel væsker til total parenteral ernæring, bør foregå på steder spesielt innrettet for slik virksomhet, for eksempel sykehusapotek» (1).
Sammendrag
Hensikt
Bruk av mikrobiologisk forurensede legemidler kan få fatale konsekvenser. Legemiddeltilvirkning i apotek underlegges strenge regelverk med kontroll av lokaler og produksjonsledd frem til ferdig legemiddel. Regelverkene gjelder derimot ikke for tilvirkning i institusjoner. Der stilles ingen krav til lokalene hvor tilsetninger og utblandinger gjøres. Ved St. Olavs Hospital foregår utblanding av sterile legemidler vanligvis på medisinrom. De mikrobielle forholdene på slike medisinrom har så vidt vi vet ikke blitt undersøkt tidligere.
Materiale og metoder
Ti medisinrom ble kartlagt mikrobielt ved prøvetaking fra overflater og luft, ved hjelp av kontaktskåler, luftsamler og nedfallsskåler som ble dyrket. I tillegg ble aktivitet på medisinrommet under luftprøvene registrert og de ansatte intervjuet om renholdsrutiner og bruk av rommet.
Resultater
Ingen av medisinrommene møtte kravene som stilles til produksjonslokaler. Funnene viste signifikant variasjon mellom og innen medisinrom. Faktorer som aktivitet, rengjøringsrutiner, ventilasjon og bygningsmasse kan påvirke disse. I nye bygg ble det funnet færre mikroorganismer enn i gamle bygg. Rom med høy aktivitet skilte seg ut med høye funn av mikrober i forhold til rom som ble lite brukt.
Konklusjon
Kartleggingen viser varierende og til dels betydelig mikrobiologisk oppvekst på medisinrommene som ble undersøkt. Disse tallene er svært mye høyere enn det som kreves for steril produksjon av legemidler i sykehusapotek med tilvirkertillatelse. Spørsmålet man kan stille er derfor om det er forsvarlig at tilsetninger til legemidler for langtidsinfusjon og med spesielt gode vekstvilkår gjøres på medisinrom hvor kontroll med mikrobiologisk forurensning er så dårlig som vist i denne undersøkelsen.
Summary
Title
Microbiological survey of medicine rooms at St.Olavs Hospital, Trondheim, Norway
Background
Sites for production of sterile medicines are controlled by strict regulations regarding the amount of microbes present. Microbiologically contaminated medicines can have a detrimental effect. Admixture and dilution of sterile medicines at St.Olavs Hospital is normally done in a medicine room. Not included in the same regulations as the production of medicines, the microbiological conditions of these rooms have as far as we know not previously been investigated.
Material and methods
Ten medicine rooms were surveyed by sampling air and surfaces using contact agars, deposition agars and an air sampler. In addition, the staff was interviewed about the cleaning procedures and use of the room.
Results
The microbiological findings varied significantly both within and between medicine rooms. This may depend on multiple factors such as activity, cleaning, and ventilation. Rooms located in newer buildings had lower depositions than those in older buildings. Rooms with a high level of activity had high findings of microbes compared to those with less activity.
Conclusion
The microbiological findings in this study questions the safety of practicing admixture of sterile medicines in medicine rooms, and infusing them for up to 24 hours.
Last ned hele artikkelen med tabeller i pdf-format.
BAKGRUNN OG HENSIKT
Mikrobiell forurensning av sterile legemidler kan gi alvorlige følger hos syke pasienter (2, 3, 4). Ved tilsetning til sterile legemidler utført ved et sykehusapotek med tilvirkertillatelse stilles det derfor krav til opprettholdt sterilitet i det ferdige produktet. Kvaliteten på sluttproduktet sikres gjennom European Commissons (EC) retningslinjer som beskriver krav og teknikker til sterilproduksjon og gir nøyaktige spesifiseringer av Good Manufacturing Practice (GMP) (5). Her beskrives også forholdene rundt selve produksjonen, det vil si produksjonslokaler og miljøet rundt steril produksjon. Renrom som benyttes til slik produksjon er inndelt i klasser. Klassifiseringen er basert på innhold av partikler og mikrober i luft samt mikrober på overflater. Det er krav om klasse A kvalitet (tabell 1) med klasse B bakgrunn ved høyrisikooperasjoner som fylling av legemidler i beholdere, åpning av ampuller og aseptiske anbrudd. Dette kan også gjøres i isolator klasse A med HEPA-filter (High Efficiency Particulate Air-filter) med minst klasse D bakgrunn. Klasse C og D kan brukes i produksjon av sterile legemidler ved mindre kritiske arbeidsoperasjoner (5). Mikrobiell monitorering gjøres ved å måle antall CFU (colony forming units): Sopp og bakterier som deponeres på agarskåler og formerer seg til en synlig koloni (se bilde øverst).

Tabell 1. Anbefalte grenser for mikrobiell monitorering som viser gjennomsnittsverdier av colony forming units (CFU) av flere parallelle målinger (5).
Krav til fravær av mikrober i produksjonslokaler står i kontrast til at identisk utblanding kan gjøres på et sykehus uten at det stilles krav til lokalene hvor dette utføres (6). Ved St. Olavs Hospital gjøres de fleste utblandinger av sterile legemidler på medisinrom hvor det tilføres vanlig romluft. Dette inkluderer utblandinger av parenteral ernæring og legemidler til spinal/epidural bruk. Disse er spesielt ømfintlige for oppvekst av mikroorganismer. Parenteral ernæring er et godt vekstmedium, og forurensninger av væsker som gis i spinalvæsken kan gi infeksjon i sentralnervesystemet. Disse løsningene gis ofte som infusjon i inntil 24 timer, noe som øker muligheten for vekst av tilførte mikrober. En kontaminasjon med en bakterie som formerer seg hvert 30. minutt i et godt vekstmedium, vil gi rundt åtte millioner bakterier etter 12 timer.
Medisinrom har så vidt vi vet ikke vært undersøkt mikrobiologisk tidligere. En mikrobiologisk kartlegging av 10 utvalgte medisinrom ble derfor utført på samme måte som en evaluering av produksjonsarealene ved et sykehusapotek.
MATERIALE OG METODER
St. Olavs Hospital har i en byggefase både nye og gamle bygg. Ved utvalg av medisinrom ble det lagt vekt på å inkludere alle byggene ved sykehuset med to eller flere sengeposter. To avdelinger var intensivposter hvor legemidlene blandes ut ved pasientens seng. De andre avdelingene hadde ulike pasientgrupper, og brukte medisinrommene sine svært ulikt. Tabell 2 oppsummerer karakteristikker ved de forskjellige avdelingene.
Medisinrommene ble kartlagt med samme innsamlingsteknikker som brukes ved miljøkontroll i produksjonsavdelingen ved Sykehusapoteket i Trondheim (tabell 3). Skålene ble plassert i de delene av medisinrommene hvor aktiviteten var antatthøyest (figur 1). Etter utførte målinger ble skålene dyrket i 5 °C over romtemperatur og antall CFU ble avlest etter 3 og 5 dager. Avlesningen på dag 5 ble brukt til statistisk bearbeiding med SPSS. Informasjon om utforming, bruk og renhold av medisinrommet ble samlet inn på forhånd. I tillegg ble aktiviteten i rommet registrert under luftinnsamlingen.

Tabell 2. Karakteristikker ved utvalgte avdelinger hvor målingene ble gjort.
N = nytt bygg, G = gammelt bygg
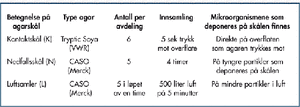
Tabell 3. Oversikt over dyrkningsskåler brukt ved kartleggingen.
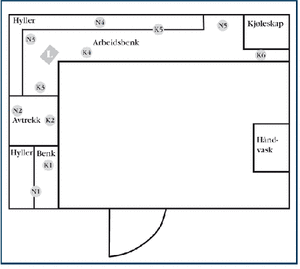
Figur 1. Oversikt over medisinrom og plassering av agarskåler.
RESULTATER
Intensivavdelingene (E og F) er kun tatt med i resultatene for luftsamleren, da de ikke kan sammenliknes med de andre medisinrommene.
Både prøvene fra nedfallsskålene (figur 2) og luftsamleren (figur 3) viser store forskjeller mellom avdelingene. Samlet er målingene fra nye bygg signifikant lavere enn i gamle bygg. Avdeling H og J ble målt to ganger på grunn av høye funn ved første måling. I duplikatmålingen var nedfallsprøvene signifikant lavere for H2 mot H1 p<0,01, mens luftprøvene var signifikant høyere for både H2 mot H1 (p<0,01) og J2 mot J1, p<0,03.
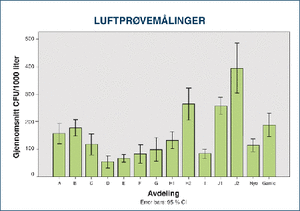
Figur 2. Gjennomsnitt CFU/m3 for luftprøvene tatt ved avdelingene A–E som er i nye bygg og F–J som er i gamle bygg. I tillegg vises gjennomsnittet samlet for avdelingene i nye bygg (Nye) og gamle bygg (Gamle). Error bars viser 95 % konfidensintervall. Forskjellen mellom Nye og Gamle er signifikant, p<0,02.
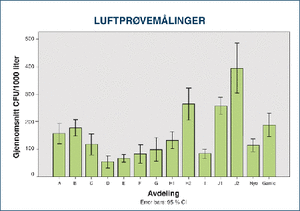
Figur 3. Gjennomsnitt CFU/4 timer for nedfallsskålene målt ved avdelingene A–D som er i nye bygg og G–J som er i gamle bygg. I tillegg vises gjennomsnittet samlet for avdelingene i nye bygg (Nye) og gamle bygg (Gamle). Error bars viser 95 % konfidensintervall. Forskjellen mellom Nye og Gamle er signifikant, p<0,001.
Luftprøvemålingen er vurdert i forhold til aktiviteten på medisinrommene som ble målt i løpet av måleperioden. En regresjonsanalyse viste r2=0,58. Dette tilsier at 58 % av økningen i antall CFU/m3 kan forklares med økende antall personer i rommet, se figur 4.
Kontaktprøvene ble tatt rundt om på forskjellige flater på rommene. Da hvert rom har et lite antall prøver, er disse gruppert for alle avdelingene, avhengig av hvor de er tatt. Figur 5 viser 95 % konfidensintervall for de forskjellige prøvestedene. Hylleprøver ble ikke tatt ved alle avdelinger og utgjordeet lite materiale. Funnene viste en tendens mot lavere verdi på avdelingen som hadde jevnlig hyllevask som en dokumentert rutine enn de som vasket ved behov (henholdsvis gjennomsnittlig 17,5 (range15–20) mot 52,2 (range19–88) CFU/skål).
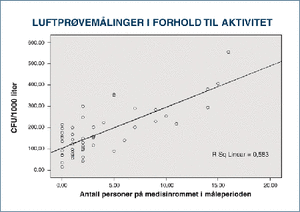
Figur 4. Resultatet fra regresjonsanalysen av luftprøvene mot aktiviteten i rommet under måleperioden, r2=0,58.
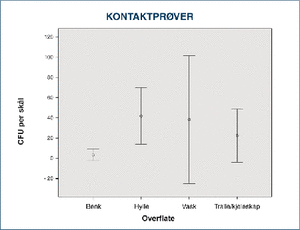
Figur 5. 95 % konfidensintervall for prøver samlet fra samtlige avdelinger, fordelt på hvor prøvene ble tatt. Oppvekst av mikroorganismer fra benk var signifikant lavere enn oppvekst på hyller p<0,01.
DISKUSJON
Alle medisinrommene ble først målt en gang, og gir kun et øyeblikksbilde av den mikrobiologiske situasjonen. Dette støttes av duplikatmålingene ved avdeling H og J som viser signifikant forskjell innenfor avdelingene når det ble foretatt målinger på to forskjellige tidspunkt.
Kontaktprøvene viste en statistisk forskjell mellom benk og hyller. Dette kan tyde på jevnlig og god rengjøring av benkeoverflatene på alle postene. Det anses imidlertid som uheldig at det er til dels store funn på hyllene. Mikroorganismer i støvlaget på hyllene vil lett kunne virvles opp i luften ved høy aktivitet eller falle ned på arbeidsbenken ved forflytning av pakninger.
Funnene fra nedfallsskålene og luftprøvemålingene viste en signifikant forskjell mellom nye og gamle bygg. Aktivitet på medisinrommene er vist å kunne være en av faktorene. Det er i tillegg flere karakteristikker ved disse bygningstypene som kan bidra til denne forskjellen. I nye bygg er låsene på medisinrommene knyttet til en alarm dersom døren blir stående oppe. I gamle bygg blir de oftere stående oppe når det er noen inne i rommet. Dette kan føre til at partikler lettere kan virvles fra korridor med mye trafikk og inn på medisinrommet. I tillegg er noen av medisinrommene i gamle bygg knyttet til pauserom og lagerrom, noe som gjør dem utsatt for trafikk. Bygningsmessig vil et nytt bygg kunne ha færre deponeringer av mikroorganismer i struktur samt nyere og kanskje bedre ventilasjonsanlegg, noe som kan bidra positivt i forhold til luftkvalitet. Vinduer kan åpnes på gamle bygg, men i dette tilfellet kun i rom D i nytt bygg. Denne avdelingen hadde lave målinger, slik at det er vanskelig å trekke en konklusjon om dette påvirker målingene eller ikke.
Luftprøvefunnene viste at det er en sammenheng mellom aktivitet på rommet og resultatene. Dette kan forklares med at de som er på medisinrommet både avgir mikroorganismer og virvler opp mikroorganismer som er til stede.
KONKLUSJON
Enkle miljøforbedrende tiltak kan være å lage rutiner hvor man alltid lukker medisinromdøren, jevnlig dokumenterer vask av hyller og benker samt reduserer antall personer som bruker medisinrommet samtidig.
Kartleggingen viser varierende og til dels betydelig mikrobiologisk oppvekst på medisinrommene som ble undersøkt. Disse tallene er svært mye høyere enn det som kreves for steril produksjon av legemidler i sykehusapotek med tilvirkertillatelse. Kravet der er totalt fravær av mikroorganismer målt med de aktuelle metodene. Økt mengde mikroorganismer på utblandingsstedet øker sannsynligheten for kontaminasjon av sterile legemidler. Denneøkte sannsynligheten i tillegg til en potensielt alvorlig konsekvens ved oppvekst, gjør at utblanding av sterile legemidler på medisinrom kan gi økt risiko for infeksjon hos pasient. Spørsmålet man kan stille er derfor om det er forsvarlig at tilsetninger til legemidler for langtidsinfusjon og med spesielt gode vekstvilkår gjøres på medisinrom hvor kontroll med mikrobiologisk forurensning er så dårlig som vist i denne undersøkelsen.
Oppgitte interessekonflikter: Ingen
Referanser
- Statens legemiddelverk. Norske Legemiddelstandarder 2004. Oslo: Gyldendal, 2004.
- Bennett SN, McNeil MM, Bland LA et al. Postoperative infections traced to contamination of an intravenous anesthetic, propofol. N Engl J Med 1995; 333:147–154.
- Macias AE, de Leon SP, Huertas M et al. Endemic infusate contamination and related bacteremia. Am J Infect Control 2008; 36:48–53.
- Macias AE, Munoz JM, Galvan A et al. Nosocomial bacteremia in neonates related to poor standards of care. Pediatr Infect Dis J 2005; 24:713–716.
- EC Guide to Good Manufacturing Practice Revision to Annex 1: Manufacture of Sterile Medicinal Products. European Commision; 2003.
- Legemiddelhåndtering for virksomheter og helsepersonell som yter helsehjelp: Rundskriv IS-9/2008: Sosial- og helsedirektoratet; 2008.
Manuskriptet ble mottatt 20. april 2009 og godkjent 29. juni 2009.
Fagredaktør Berit Smestad Paulsen.
Norsk Farmaceutisk Tidskrift 2009; 10: 26–9.
