Når konserveringsmidler møter sin overmann
Sammendrag
Hensikt
Noen sopparter har evnen til å vokse i legemidler og næringsmidler som inneholder konsentrasjoner av sure konserverende stoffer som grenser mot, eller overstiger, de anbefalte maksimalverdiene. Herværende presentasjonen har som hensikt å forklare resistensmekanismene som ligger til grunn for rapportert soppvekst i en efedrinmikstur og å drøfte hvordan dette problemet kan løses.
Materiale og metoder
Resistens overfor konserveringsmidler som tilhører klassen svake organiske syrer forklares basert på eksperimentelle data og tidligere publisert forskning på området. Bakgrunnen er funn av høy soppkonsentrasjon i en mikstur fremstilt ved et norsk produksjonsapotek.
Resultater
Zygosaccharomyces bailiible påvist i høyt antall i en efedrinmikstur. Gjærarten ble sannsynligvis introdusert i flaskene via råsaften brukt som smakstilsetning. DaZygosaccharomyces bailiible tilsatt nye flasker som inneholdt enten sorbat eller benzoat som konserveringsmiddel, vokste den til i overkant av 150 000 celler/ml. Dette var et resultat av soppens resistensegenskaper.
Konklusjon
Vekst avZygosaccharomyces bailii i en efedrinmikstur som inneholdt enten sorbat eller benzoat, viser at disse mye brukte konserveringsmidlene i noen tilfeller kan ha utilstrekkelig effektivitet. Forståelse av resistensmekanismer som Zygosaccharomyces bailiiog andre sopparter innehar er viktig for utvikling av preparatsammensetning, fremstillingsmetode og fastsetting av oppbevaringsbetingelser.
Hovedbudskap
Noen sopparter har evnen til å vokse til et høyt antall i næringsmidler og legemidler som inneholder lipofile, svake organiske syrer som konserverende stoff. Dette kan forringe det ferdige produktets kvalitet, medføre økonomisk tap for produsenten og i noen tilfeller representere en helserisiko.
Sopparter innehar ulike resistensmekanismer overfor konserveringsmidler. En forståelse av disse mekanismene er viktig i legemiddelproduksjon og -oppbevaring.
Summary
When Preservatives Meet Their Match
Regrowth of fungi in products containing weak organic acids as preservative
Background
Some species of fungi are able to grow in foods, beverages and medicines containing weak acid preservatives at concentrations which are close to or exceed the maximum recommended values. This study aims to explain the resistance mechanisms which underlie a previous finding of high numbers of yeasts in an ephedrine cough mixture, and to discuss how this problem may be solved.
Material and methods
Resistance to preservatives belonging to the class weak organic acids is explained by reference to previously published studies. The presentation is built around a previously reported growth of the yeastZygosaccharomyces bailiiin high numbers in a liquid ephedrine mixture produced at a Norwegian pharmacy.
Results
Zygosaccharomyces bailliwas found in high numbers in an ephedrine cough mixture. The yeast was probably present in the berry extract used as flavouring in the cough mixture and then grew in the bottles. When reintroduced into the cough mixture made with either sorbate or benzoate as preservative,Zygosaccharomyces bailiiwas able to grow in excess of 150,000 cells/ml. This was a consequence of resistance to preservatives of the weak-acid type.
Conclusion
The growth ofZygosaccharomyces bailiiin an ephedrine cough mixture containing either benzoate or sorbate as preservative, shows that these commonly used preservatives can fail. An understanding of the resistance mechanism employed by this yeast and others, is necessary when choosing how medicines should be composed, prepared and stored.
Last ned hele artikkelen i pdf-format.
BAKGRUNN OG HENSIKT
I 2004 rapporterte nettsidene til NRK Østlandssendingen om funn av store mengder gjærsopp i en efedrinmikstur (1). Funnet førte til at 15 000 flasker ble trukket tilbake fra markedet. På daværende tidspunkt var efedrinmiksturen tilgjengelig i Norge med natriumbenzoat (0,1 %) som konserveringsmiddel. Soppen som ble funnet (Zygosaccharomyces bailii) fryktes for nettopp sin evne til å motstå de antimikrobielle mekanismene som forbindes med svake organiske syrer (2). Konserveringsmidler som er vanlige i matvarer er bortimot alltid svake syrer (eddiksyre, propionsyre, SO2 (som sulfitt/bisulfitt), sorbinsyre og benzosyre) (3) og sopparten har forårsaket store økonomiske tap for næringsmiddelindustrien (2).
Denne oversiktsartikkelen har som mål å se nærmere på virkningsmekanismene til svake organiske syrer som konserveringsmidler, med spesiell vekt på et tidligere rapportert tilfelle der det ble funnet sopp i en mikstur produsert i Norge (1, 4).
MATERIALE OG METODER
Følgende eksperimentelle detaljer er hentet fra en tidligere publisert studie (4) og gjengir fremgangsmåten for identifisering og resistensbestemmelsen av en soppart som ble funnet i høyt antall i en norskprodusert efedrinmikstur (1).
Arten (Zygosaccharomyces bailii) som ble funnet i miksturen ble identifisert basert på sekvensering av 18S rDNA-genet og gjennom sin enestående evne til å vokse på selektive medier tilsatt kaliumsorbat (0,1 %) og eddiksyre (0,5 %) som selektive agens (4).
For å undersøke om toleranse/resistens mot benzosyre lå til grunn for ettervekst av Z. bailii i efedrinmiksturen, ble den fremstilt med 0,1 % natriumbenzoat, 0,1 % kaliumsorbat (begge syrer) eller parabenblanding (0,1 - 0,15 %). Tabell 1 oppgir miksturenes sammensetning og pH.

Tabell 1. Sammensetning av efedrinmikstur.
Flaskene ble så tilsatt Z. bailii til en startkonsentrasjon på 105-106 celler/ml. Forandringer i soppkonsentrasjonen ble fulgt over en periode på 28 døgn ved utstryk av prøveporsjoner på testagar (4, 5). Ved endt vekstforsøk ble celler som hadde vokst i flasker tilsatt kaliumsorbat overført til nye flasker tilsatt natriumbenzoat og omvendt, for å undersøke om resistensen var syrespesifikk (4).
Minste hemmende konsentrasjoner ble målt for natriumbenzoat og kaliumsorbat for både Z. bailii og vanlig bakegjær (Saccharomyces cerevisiae) (4 og referanser i denne).
Data og teorier innhentet fra publisert litteratur på området, ble brukt parallelt med våre tidligere resultater (4) for å forklare nærmere hvordan Z. bailii sannsynligvis ble introdusert i flaskene, hvordan den kunne vokse og hvilke tiltak som må til for å forhindre liknende episoder i fremtiden.
RESULTATER
Følgende resultater er hentet fra en tidligere publisert studie (4). Det gjengis informasjon om identiteten til en soppart (Zygosaccharomyces bailii) som ble isolert fra en efedrinmikstur og det dokumenteres soppens evne til å vokse i nærvær av sure konserveringsmidler.
Soppen funnet i efedrinmiksturen konservert med natriumbenzoatble identifisert som Z. bailii basert på sekvensering av 18S rDNA-genet og vekst på selektive medier tilsatt sorbat og eddiksyre (4).
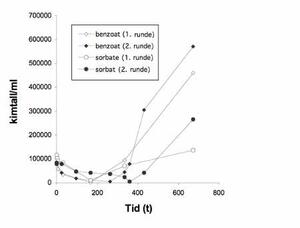
Figur 1. Forandringer i konsentrasjonen til Zygosaccharomyces bailii i miksturer tilsatt 0,1 % natriumbenzoat eller 0,1 % kaliumsorbat. Figuren viser resultatene fra to runder med testing og er hentet fra en tidligere publikasjon (5).
Da Z. bailii ble reinokulert i efedrinmiksturene tilsatt 0,1 % kaliumsorbat eller 0,1 % natriumbenzoat, ble antallet formeringsdyktige soppceller redusert eller hemmet i løpet av 14 døgn for deretter å øke til mer enn 150 000 celler/ml. Tallet er tilnærmet lik kontaminasjonsnivået som ble påvist da miksturen ble trukket tilbake fra markedet (1). Figur 1 viser utfallet av testen med miksturer tilsatt kaliumsorbat eller natriumbenzoat.
Celler som vokste i miksturen tilsatt natriumbenzoat vokste umiddelbart i flasker tilsatt kaliumsorbat og omvendt. Dette indikerer overlappende resistensmekanismer. Den minste hemmende konsentrasjon (mM) for natriumbenzoat og kaliumsorbat for Z. bailii/S. cerevisiae var henholdsvis 5,0-10/2,5 og 5,0-10/2,5 (4). Den kontaminerte efedrinmiksturen der soppen opprinnelig ble påvist inneholdt 0,1 % (ca. 7 mM) natriumbenzoat (1).
Reinokulering av Z. bailii i nye flasker med parabener som konserveringsmiddel, førte til en rask reduksjon i antall formeringsdyktige celler til under deteksjonsgrensen uten påfølgende ettervekst. Ved bruk av spiritus conservans (0,1 % parabener) ble ingen formeringsdyktige sopp påvist i prøven tatt 10. døgn etter inokulering (4) og kriteriene for konserveringsmiddeleffektivitet som skissert i den europeiske farmakopeen (5) var oppfylte. Parabener brukes nå i fremstillingen av miksturen.
DISKUSJON
Figur 1 viser at Z. bailii har evnen til å formere seg i høyt antall i efedrinmikstur tilsatt natriumbenzoat eller kaliumsorbat. Dette er ikke en evne som alle sopparter er i besittelse av. Av i alt ca. 800 kjente gjærarter, er det kun et fåtall som ofte forbindes med forringet næringsmiddelkvalitet (6). Næringsmidler som typisk tillater vekst av slike gjærsopper har ofte likhetstrekk med efedrinmiksturen: lav pH og en betydelig konsentrasjon av forgjærbart sukker og organiske syrer.
Zygosaccharomyces er en slekt som omfatter arter som forgjærer, er osmotolerante og resistente overfor konserveringsmidler og etanol (6). Z. bailii er mer resistent enn noen andre gjærarter overfor konserveringsmidler og regnes som arten som har påført størst økonomisk tap for næringsmiddel- og vinindustrien (7).
Vekst ved konsentrasjoner av konserveringsmidler som er langt høyere enn de høyeste tillatte konsentrasjoner i næringsmidler i Europa, og ved pH-verdier under syrens pKa-verdi er dokumentert for denne arten (8 og referanser i denne). Viktigheten av pKa-verdien i forbindelse med konservering er diskutert under. At antallet formeringsdyktige sopp først synes å bli redusert (basert på kolonitall på agar) i efedrinmiksturen for så å øke (figur 1), kan forklares ved at cellene trenger tid til å tilpasse seg nærværet av konserveringsmiddel. Alternativt er noen få av de tilsatte cellene resistente, overlever i flaskene og vokser opp i høyt antall. De liknenderesponskurvene for to ulike svake organiske syrer (figur 1), og observasjonen om at celler som har tilpasset seg den ene syren vokser umiddelbart i nærvær av den andre, kan være et tegn på overlappende tilpasnings-/resistensmekanismer. Se diskusjon under.
Den minste hemmende konsentrasjonen for både natriumbenzoat og kaliumsorbat mot Z. bailii var tilnærmet lik konserveringsmiddelkonsentrasjonen (0,1 %; 7 mM) i efedrinmiksturen. Minste hemmende konserveringsmiddelkonsentrasjon mot S. cerevisiae var imidlertid kun 2,5 mM, det vil si langt under konsentrasjonen av konserveringsmiddel brukt i miksturen (1). I temaskrivet 40/96 Konservering av legemidler i apotek (9) kan man lese at preparatet skal inneholde tilstrekkelig konserveringsmiddel til at aktiviteten beholdes gjennom lagring og bruk. Det stilles ingen krav til øvre brukskonsentrasjon, men det bemerkes at en konsentrasjon på 0,1 (-0,2) % vanligvis benyttes. Den europeiske unionen (direktiv 95/2/EC) (10) tillater maksimum 1,6 mM (ca. 0,025 %) kaliumbenzoat i alkoholfrie drikker. Basert kun på minste hemmende konsentrasjoner er disse produktene i faresonen for vekst av Z. bailii.
Det anses som sannsynlig at bærsaften var kontamineringskilden. Råsaften brukt som smakstilsetning (tabell 1) er normal pressaft som etter bunnfelling og klaring konserveres før bruk. Varmebehandling benyttes normalt ikke. Efedrinsaken har for øvrig felles trekk med en hendelse fra forfatterens tid ved et kommunalt næringsmiddeltilsyn. En nyoppstartet produsent av sportsdrikk leverte stadig flasker til testing som viste seg å inneholde mange tusen soppceller per ml. Kontaminasjonen var utelukkende i flasker tilsatt jordbærekstrakt. Den andre smaken, sitron, var alltid fri for sopp. Lav pH, sukker og nærvær av svake organiske syrer gjenspeiler miljøer (for eksempel bær) som er naturlige oppholdssteder for sopp. Evnen til formering i miksturen og sportsdrikken anses da å ha et logisk og evolusjonsmessig utspring i soppens naturlige tilholdssteder.
Den konserverende effekten av svake organiske syrer
Hvorfor har lipofile, svake organiske syrer en konserverende effekt? Det er godt kjent at slike syrer bare utøver en effekt ved pH- verdier i nærheten av eller under pKa-verdien. Tilstrekkelig med ikke-dissosiert syre må da være sentralt for aktiviteten, og noen resistensmekanismer må være rettet mot å motarbeide svaksyreeffekten.
Likningen under viser dissosieringsreaksjonen for svake syrer i akvatiske miljøer
AH + H2O ↔ H3O+ + A-
F.eks. C6H5COOH (benzosyre) +
H2O ↔ H3O+ + C6H5COO- (benzoat)
A = anionet
pH-verdien i efedrinmiksturen er ca. 3,5 (ekstracellulær pH) mens den intracellulære pH-verdien er ca. 7,0. Miksturens pH er betraktelig lavere enn benzosyres pKa (4,2), og dermed er >> 50 % av molekylene i den udissosierte formen (AH). Ifølge klassisk teori (11), initieres den antimikrobielle effekten ved en rask og passiv diffusjon av ikke-dissosierte (ikke-ladede) lipofile syremolekyler gjennom cellemembranen. Fordi cellens indre rom har en pH-verdi nær nøytral, vil syren dissosiere til anioner (A-) og protoner (H3O+). Ladningen på disse gjør dem nærmest uløselige i lipidlaget og det blir opphopning av begge i den indre delen av membranen og i cytosol. Ifølge modellen vil denne opphopningen forårsake etkatastrofalt fall i pH som forringer cellens metabolisme (se under). Viktigheten av en betraktelig andel av ikke-dissosierte molekyler er forklaringen på hvorfor benzosyre, sorbinsyre og eddiksyre kun velges til beskyttelse av syrlige preparater og matvarer. Figur 2 oppsummerer den klassiske svaksyreeffekten. Punkt «c» i figuren omtales under.
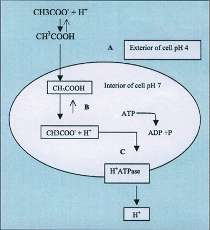
Figur 2. Forskjellen i ekstracellulær og intracellulær pH ligger til grunn for den klassiske forklaringen på hvorfor svake organiske syrer virker konserverende (12). Eddiksyre (CH3COOH) er ca. 15 % dissosiert ved pH 4 utenfor celle (A). Ved pH 7 i cellen (B) er mer enn 99 % dissosiert. Protonpumper (C) fjerner H+ - overskuddet fra cellen. Surgjøring av cytoplasma under svaksyreindusert stress som representert i denne figuren er blitt påvist eksperimentelt hos både gjær- og muggsopp (13, 14).
Opphoping av H3O+ og A- forventes å ha diverse påvirkninger på cellen. Et fall i intracellulær pH vil hemme mange metabolske prosesser, blant annet glykolyse (13). Dette skjer gjennom hemning av enzymer, spesielt fosfofruktokinase. Opphopning av anionet (figur 2) påvirker også det osmotiske trykket i cellen (15). Samtidig som energiproduksjon i glykolysen forringes, opplever spesielt S. cerevisiae celler et sterk energitap (ATP) gjennom induksjon og bruk av transportproteiner (16 og referanser i denne) for å motarbeide oppkonsentrering av anionet og protoner (figur 2).
Lipofile konserveringsmidler vil kunne forringe membrantransportprosesser og energikobling i mitokondriene under aerobe forhold (15). Elektrontransport i mitokondrier er hovedkilden til produksjon av reaktive oksygenforbindelser (RO), blant annet superoksid-anionet. Det er holdepunkter for at svake organiske syrer styrker effekten til RO produsert av elektrontransportkjeden i gjærceller, og at dette også gir en økning i mutasjoner i mitokondrielt DNA (15).
Resistente sopparter må kunne motstå eller motarbeide effekten som er skissert i figur 2. En generell «forsuringsmodell» kan forklare hvorfor både sorbinsyre og benzosyre delvis var effektive mot Z. bailii ved pH 3,5 i miksturen (figur 1). På liknende måte kan allmenne resistens/toleranse-mekanismer forklare hvorfor Z. bailii celler som vokser i nærvær av benzosyre også vokser umiddelbart når de blir overført til mikstur med sorbinsyre og omvendt. Imidlertid er det blitt observert at monokarboksylsyrene eddiksyre og sorbinsyre som har nesten identiske pKa-verdier, har svært forskjellig konserverende effekt; sistnevnte er den mest effektive (7). Denne og liknende observasjoner krever en annen eller en mer nyansert tolkning av aktiviteten til svake syrer enn den som er implisitt i figur 2. Sorbinsyre (figur 3) er mer lipofil enn eddiksyre (figur 2). Noen forskningsresultater indikerer at den mer lipofile sorbinsyren løser seg i biologiske membraner og at dette endrer membranens struktur (17, 18). Dessuten ble ikke en reduksjon i intracellulær pH registrert da S. cerevisiae ble utsatt for sorbat (19). Apoptose (programmert celledød) ble indusert av 20-80 mM eddiksyre hosS. cerevisiae, men en liknende effekt er ikke blitt rapportert for sorbinsyre og benzosyre (20, 21). Disse observasjonene satt sammen tyder på at den konserverende effekten til monokarboksylsyrer ved en bestemt pH er en funksjon av pKa og log D (lipofilisiteten ved den aktuelle pH-verdien), og sannsynligvis også andre strukturspesifikke aspekter av konserveringsmidlene. Sorbinsyre har et system av konjugerte dobbeltbindinger som gjør molekylet utsatt for nukleofilt angrep. Både posisjon-3 og spesielt posisjon-5 i molekylet (figur 3) er potensielle kandidater for angrep fra sterkt nukleofile agens (22).

Figur 3. Sorbinsyre kan utsettes for nukleofilt angrep. Figuren viser mulige angrepspunkter for nukleofile agens (Nu).
Det er for eksempel blitt foreslått at sorbinsyre binder seg kovalent til sulfhydryl-gruppene (tiol-addering) i enzymer som deltar i karbohydratmetabolismen og hemmer aktiviteten til disse (23-25). Burlini et al. (26) rapporterer om flere anionspesifikke effekter på sukkermetabolismen og fører bevis for at disse er mer utslagsgivende enn et eventuelt fall i den intracellulære pH-verdien.
Resistens/toleranse-strategier
S. cerevisiae regnes som moderat resistent overfor svake syrer. Arten kan dekarboksylere sorbinsyre, men denne aktiviteten synes å bidra lite til resistensutviklingen (8). Hos S. cerevisiae er det imidlertid blitt påvist at fjerning av PDR12-genet (som koder for en anionpumpe, pdr12p) gjør cellene mer følsomme overfor benzosyre, sorbinsyre og eddiksyre (27). Når S. cerevisiae dyrkes i nærvær av 0,5-2,5 mM sorbat eller benzoat, arresteres cellesyklusen. Etter flere timer starter veksten igjen og cellene er nå tilpasset syrene (28 og referanser i denne). Dette skjer som en konsekvens av induksjon av visse plasmamembranpumper som pumper ut syren. pdr12p (en ABC-transportør) i plasmamembranen pumper sorbat- og benzoatanioner ut fra den indre delen av plasmamembranen og/eller cytosol. Produksjon av dette proteinet induseres som stressrespons og konserveringsmiddelstressede celler bruker mye energi på aktivt å kvitte seg med anionene (28). I tillegg er bidraget av H+-ATPase (protonpumpe) (figur 2, pkt. C) kjent for å motvirke fall i intracellulær pH hos S. cervesiae. Aktiviteten og muligens mengden av dette enzymet øker i svaksyrestressede S. cerevisiae celler (28-30). Det vil si, hovedstrategien til S. cerevisiae synes å være bruk av beskyttende pumper som utstøter H+ og anioner (28, 29).
Z. bailii er enda mer resistent overfor konserveringsmidler enn S. cerevisiae. Dette gjenspeiler seg i for eksempel konserveringsmidlenes minste hemmende konsentrasjoner. I en Z. bailii-kultur viser individuelle celler stor variasjon med hensyn til sorbinsyreresistens, og noen få celler er meget resistente (6). Potensialet for ettervekst i kontaminerte produkter vil da avhenge sterkt av den opprinnelige kontaminasjonsgraden, og her kan råvarekvaliteten være viktig. Steels et al. (6) viste at reinokulering av resistente Z. bailii ga en distribusjon av resistensfenotyper lik den i den opprinnelige populasjonen. Det ble konkludert med at resistente celler ikke representerer en genetisk unik undergruppe, det vil si at resistensfenotypen ikke er arvelig.
Resistensstrategien hos Z. bailii synes å være enannen enn den man finner hos S. cerevisiae. I motsetning til S. cerevisiae skjer ikke merkante forandringer i sammensetningen av plasmamebranproteiner som en konsekvens av syreindusert stress hos Z. bailii (29). Resistens hos Z. bailii har blitt foreslått i stor grad å skyldes redusert opptak av konserveringsmiddelet (31) samt potensialet for dets oksydative nedbryting (32). Z. bailii celler som er tilpasset vekst i nærvær av benzosyre viser 40 % mindre opptak av forbindelsen (31). Redusert opptak kan muligens også være en årsak til manglende eller beskjeden induksjon av effluksproteiner i plasmamembranen. Basert på måling av H+ utpumping hos benzosyre-stressede Z. bailii i aktiv vekst, er det imidlertid nylig blitt foreslått at H+-ATPase (protonpumpe) bør regnes som en resistensfaktor (7).
Flere studier peker på metabolsk omdanning av konserveringsmidler som en viktig resistensmekanisme hos Z. bailii. Z. bailii kan, under aerobe forhold, metabolisere benzosyre og sorbinsyre i nærvær av ZbYME2-genet som koder for en monookysgenase med 4-hydroksylaseaktivitet. Benzosyre blir omdannet via 4-hydrokysbenzosyre og både benzosyre og sorbinsyre kan fungere som eneste karbonkilde. Et tilsvarende enzym mangler hos S. cerevisiae (32).
Hvordan Z. bailii reduserer opptaket av sure konserveringsmidler er ikke kartlagt, men det er kjent at mannoproteiner i celleveggen kan redusere permeabiliteten (33). Tilpasning kan muligens komme av en reduksjon i celleveggens porøsitet. Hos Zygosaccharomyces rouxii blir membranens fettsyresammensetning forandret i nærvær av sorbat (34). Slike forandringer kan påvirke membranens permeabilitet som i sin tur kan føre til redusert følsomhet overfor syren. «Barriere»-strategien hos Z. bailii synes mer fullkommen enn bruk av membranpumper. Det er fordi den utpumpede syren like gjerne kan diffundere inn igjen, i det som betegnes som en futile cycle. Syklusen vil påføre cellen et langvarig, kritisk tap av ATP-reserver. Dermed er det blitt foreslått at redusert opptak må være sentralt for tilpasning også hos S. cerevisiae. Det er mulig at Z. bailii er mer effektiv i å hindre fri passasje av syrlige konserveringsmidler enn S. cerevisiae og at dette er hovedfaktoren i resistensforskjellen (28).
KONKLUSJON
Svake organiske syrer ved vanlig brukskonsentrasjon kan ha utilstrekkelig konserverende effekt overfor Z. bailii. Denne arten bruker ulike mekanismer i oppnåelse av konserveringsmiddeltoleranse og -resistens. Er det tiltak som kan brukes for å unngå ettervekst av Z. bailii i miksturer og andre produkter? Oppbevaring av efedrinmiksturen ved den anbefalte temperaturen (2-8°C, merket på flaskene) synes å være det enkleste tiltaket. Hvis mulig kan varmebehandling av råvarene minske faren for kontaminasjon med formeringsdyktige celler. Kvaliteten på råvarene (mengde sopp som finner veien til flaskene) vil også være av betydning. Testene som utføres på råvarer og under produktkontroll er etter forfatterens oppfatning av altfor generell karakter. Agarskåler som er skreddersydd til å vise veksten av kun konserveringsmiddelresistente sopp er lett å lage og tolkes (4), og kunne utgjøre en del av testerutinene i forbindelse med legemiddelproduksjon.
Parabener (som var effektive mot Z. bailii) er de mest brukte konserveringsmidlene i flytende preparater til oral og utvortes bruk, og siden overgangen til disse harikke liknende episoder blitt rapportert for den norskproduserte efedrinmiksturen.
Oppgitte interessekonflikter: Ingen
Referanser
- NRK Østlandsendingen, www.nrk.no/nyheter/distrikt/nrk_ostlandssendingen/3537724.html
- Thomas DS, Davenport RR. Zygosaccharomyces cerevisiae - a profile of characteristics and spoilage activities. Food Microbiol 1985; 2: 157-69.
- Stratford M, Eklund T. Organic acids and esters. IN Food Preservatives 2nd edn. New York: Kluwer Academic Plenum Publishers 2003.
- Charnock C, Finsrud T, Foss C. Controlling the proliferation of Zygosaccharomyces bailii in ephedrine anti-phlegm cough mixture 2005; 30: 329-55.
- European Directorate for the quality of medicines. European Pharmacopoeia, 4th edn. Strasbourg: Council of Europe, 2002.
- Steels H, James SA, Roberts IN. Sorbic acid resistance: the inoculum effect. Yeast 2000; 16: 1173-83.
- Macpherson N, Shabala L, Rooney H et al. Plasma membrane H+ and K+ transporters are involved in the weak acid preservative response of disparate food spoilage yeasts. Microbiol 2005; 151: 1995-2003.
- Stratford M, Plumridge A, Archer DB. Decarboxylation of sorbic acid by spoilage yeasts is associated with the PAD1 gene. Appl Environ Microbiol 2007; 73: 6534-42.
- Norges Apotekerforening. Temaskrivet 40/96 Konservering av legemidler i apotek. Oslo: Norges Apotekerforening, 1996.
- The European Commision. Council directive 95/2/EC on food additives other than colours and sweetners. Strasbourg: The European Commision, 1995.
- Cole MB, Kiernan MHJ. Effects of weak acids and external pH on the intracellular pH of Zygosaccharomyces bailii and its implications in weak-acid resistance. Yeast 1987; 3: 23-32.
- Beales N. Adaptation of microorganisms to cold temperatures, weak acid preservatives, low pH, and osmotic stress: a review. Comp Rev Food Sci Food Safety 2004; 3: 1-20.
- Krebs HA, Wiggins D, Stubbs M et al. Studies on the mechanism of the antifungal action of benzoate. Biochem J 1983; 214: 637-63.
- Plumridge A, Hesse SJA, Watson AJ et al. The weak acid preservative sorbic acid, inhibits conidial germination and mycelial growth of Aspergillus niger through intracellular acidification. Appl Environ Microbiol 2004; 70: 3506-11.
- Piper PW. Yeast superoxide dismutase mutants reveal a prooxidant action of weak organic acid food preservatives. Free Radic Biol Med 1999; 27: 1219-27.
- Mollapour M, Fong DN, Balakrishnan K et al. Screening the yeast deletion mutant collection for hypersensitivity and hyperresistance to sorbate, a weak organic acid food preservative. Yeast 2004; 21: 927-46.
- Stratford M, Anslow PA. Comparison of the inhibitory action on Saccharomyces cerevisiae of weak-acid preservatives, uncouplers, and medium-chain fatty acids. FEMS Microbiol Lett 1996; 142: 53-8.
- Stratford M, Anslow PA. Evidence that sorbic acid does not inhibit yeast as a classic «weak acid preservative». Lett Appl Microbiol 1998; 27: 203-6.
- Arneborg N, Jesperson L, Jakobsen M. Individual cells of Saccharomyces cerevisiae and Zygosaccharomyces bailii exhibit different short-term intracellular pH responses to acetic acid. Arch Microbiol 2000; 174: 125-8.
- Ludovico P, Sousa MJ, Silva MT et al. Saccharomyces cerevisiae commits to a programmed cell death process in response to acetic acid. Microbiol 2001; 147: 2409-15.
- Ludovico P, Sansonetty F, Silva MT et al. Acetic acid induces a programmed cell death process in the food spoilage yeast Zygosaccharomyces bailii. FEMS Yeast Res 2003; 3: 91-6.
- Khandelwal GD, wedzicha B. Nucleophilic recations of sorbic acid. Food Addit Contam 1990a; 75: 685-94.
- Russel AD. Factors influencing the efficacy of antimicrobial agents. IN Principles and practice of disinfectant, preservation and sterilization. Oxford: Blackwell Science Publications, 1982.
- Eklund T. Mechanisms of action of food preservation procedures. London: Elsevier Applied Science, 1989.
- York GK, Vaughn RH. Mechanisms in the inhibition of microorganisms by sorbic acid. J Bacteriol 1964; 88: 411-417.
- Burlini N, Pellegrini R, Facheris P et al. Metabolic effects of benzoate and sorbate in the yeast Saccharomyces cerevisiae at neutral pH. Arch Microbiol 1993; 159: 220-24.
- Piper P, Mahe Y, Thompson S et al. The Pdr12 ABC transporter is required for the development of weak organic acid resistance in yeast. EMBO J 1998; 17: 4257-65.
- Piper P, Ortiz-Calderon C, Hatzixanthis K et al. Weak acid adaptation: the stress response that confers yeasts with resistance to organic acid food preservatives. Microbiol 2001; 147: 2635-42.
- Holyoak CD, Stratford M, McMullin Z et al. Activity of the plasma membrane H(+)-ATPase and optimal glycolytic flux are required for rapid adaptation and growth of Saccharomyces cerevisiae in the presence of the weak-acid preservative sorbic acid. Appl Environ Sci 1996; 62: 3158-64.
- Viegas CA, Sa-Correia I. Activation of plasmamembrane ATPase of Saccharomyces cerevisiae by octanoic acid. J Gen Microbiol 1991; 137: 643-51.
- Warth AD. Transport of benzoic and propanoic acids by Zygosaccharomyces bailii. J Gen Microbiol 1989; 135: 1383-90.
- Mollapour M, Piper PW. The ZbYME gene from the food spoilage yeast Zygosaccharomyces bailii confers not only YME2 functions in Saccharomyces cerevisiae but also the capacity for catabolism of sorbate and benzoate, two major weak organic acid preservatives. Mol Microbiol 2001; 42: 919-30.
- De Nobel JG, Barnett JA. Passage of molecules through yeast cell walls: a brief essay-review. Yeast 1991; 7: 313-23.
- Golden DA, Beuchat LR, Hitchcock HL. Changes in fatty acid composition of various strains of Zygosaccharomyces rouxii as influenced by solutes, potassium sorbate and incubation temperature. Int J food Microbiol 1994; 21: 293-303.
Manuskriptet ble mottatt 15. desember 2008 og godkjent 24. mars 2009.
Fagredaktør Berit Smestad Paulsen.
Norsk Farmaceutisk Tidsskrift 2009; 4: 22–6.
