Slimhinneklebende formuleringer
Sammendrag
Hensikt
Denne artikkelen skal gi en oversikt over etablerte bruksområder for slimhinneklebende formuleringer, samt presentere nye og innovative muligheter innenfor feltet.
Materiale og metoder
Kommersielt tilgjengelige preparater gjennomgås som eksempler på kliniske bruksområder. De terapeutiske muligheter som diskuteres her er beskrevet i forskningsartikler, publisert i engelskspråklige, internasjonale vitenskapelige tidsskrifter.
Resultater
Slimhinneklebing kombinert med forsinket frisetting kan forbedre levering av virkestoff lokalt til slimhinner, hvilket er relevant ved lokal behandling av for eksempel betennelse, infeksjon, smerte og kreft. Slimhinneklebende preparater for lokal effekt i vagina og munnhulen er kommersielt tilgjengelige. I tillegg kan systemisk biotilgjengelighet av ulike typer virkestoff økes dersom slimhinneklebing kombineres med beskyttelse av virkestoffet mot enzymatisk nedbrytning. Eksempler på aktuelle slimhinner for systemisk administrering er slimhinnene i tynntarmen, nesen og munnhulen. Slimhinnevaksinering har noen fordeler sammenliknet med tradisjonell vaksinering, og, sammen med levering av DNA, representerer et innovativt område der slimhinneklebing kan utnyttes.
Konklusjon
Selv om de kliniske bruksområdene for slimhinneklebende preparater fremdeles er beskjedne, er de terapeutiske mulighetene enorme. Noen utfordringer gjenstår det imidlertid fremdeles å løse.
Hovedbudskap
Slimhinneklebende formuleringer kan utnyttes både for å oppnå en bedre lokal behandling på slimhinner, og for å øke systemisk biotilgjengelighet til ulike typer virkestoff.
Ved å feste en formulering til lukteregionen i nesen, kan virkestoff leveres direkte til hjernen.
Slimhinnevaksinering og levering av DNA representerer innovative bruksområder.
English summary
Title
Mucoadhesive formulations- clinical applications and therapeutic opportunities
Background
Mucoadhesion occurs when a formulation adheres to one of the mucous membranes of the body. During approximately the last 30 years, an enormous amount of research addressing issues like mechanisms of adhesion, mucoadhesive polymers and various methods of testing mucoadhesion etc. has been published.
Material and methods
This review will give an overview of the clinical applications (reflected in commercially available products) and various therapeutic opportunities described in research literature published in English written international scientific journals.
Results
Mucoadhesion combined with sustained drug delivery can be exploited for improving mucosal delivery of drugs in cases of local treatment of for example inflammation, infection, painful conditions and cancer. Vaginal and buccal products are commercially available. The transmucosal (systemic) bioavailability of various drugs can be improved if mucoadhesion is combined with protection against enzymatic breakdown. Examples of mucosal membranes are the small intestine, nasal membrane and the buccosa for which some commercially available products are presented. Mucosal vaccination has some advantages compared to traditional vaccination, and, combined with DNA delivery, represents an innovative field of exploiting mucoadhesion.
Conclusion
Even though the clinical applications so far are modest, the therapeutic opportunities are enormous. However, some obstacles still have to be overcome.
Last ned hele artikkelen i pdf-format.
BAKGRUNN OG HENSIKT
En slimhinneklebende formulering vil kunne feste seg uspesifikt til slimlaget som dekker slimhinnene i kroppen. Formuleringen kan senere løsrives eller bli værende til slimlaget fornyes. I løpet av de siste cirka 30 årene, har det blitt forsket veldig mye på fenomenet slimhinneklebing, for eksempel mekanismene som ligger bak, hvilke polymere som er slimhinneklebende og hvilke målemetoder som kan benyttes. Et standard søk på vitenskapelige artikler i SciFinder på det engelske ordet «mucoadhesion» vil gi omtrent 2000 treff. Denne oversiktsartikkelen vil gi et innblikk i kliniske bruksområder og terapeutiske muligheter ved å utnytte slimhinneklebing.
Slimhinner dekker kroppens ytre overflater, for eksempel i munnhulen, magetarmsystemet (inkludert spiserøret, magesekken, tynntarmen og tykktarmen), øyet, nesen, lungene og urogenital systemet (inkludert for eksempel vagina og urinblæren). Alle disse stedene kan utnyttes av slimhinneklebende formuleringer. De generelle fordelene er en bedre effekt av virkestoffet ved lokal behandling av sykdomstilstander på slimhinnen, øket systemisk biotilgjengelighet av virkestoff og mindre hyppig readministrering.
MATERIALE OG METODER
Kommersielt tilgjengelige preparater gjennomgås som eksempler på kliniske bruksområder. De terapeutiske muligheter som diskuteres her er beskrevet i forskningsartikler, publisert i engelskspråklige, internasjonale vitenskapelige tidsskrifter.
RESULTATER OG DISKUSJON
Lokal behandling
For lokal behandling av sykdomstilstander som betennelser, infeksjoner, smerte og kreft, kan slimhinneklebing kombinert med forsinket frisetting forbedre effekten av virkestoffet, redusere virkestofftap og nødvendigheten for hyppig readministrering. Et mer sjeldent bruksområde er lokal diagnostisering.
Lokal applikasjon har blitt utnyttet i ulike sammenhenger: Effekten til xylometazolin (mot tett nese) ble økt, og bivirkningene redusert, vist ved sammenlikning med kommersielt tilgjengelige preparater (1). En slimhinneklebende nasal Rhinocort pulverspray, for behandling av allergi, er kommersielt tilgjengelig. Lungeslimhinneklebende mikropartikler med beklometason (for å redusere nødvendigheten for gjentatte doseringer ved astma) (2) og med rifampicin (mot tuberkulose) (3) har blitt undersøkt. Det har blitt gjort forsøk på å øke behandlingseffektiviteten av Heliobakter pylori infeksjoner i magen (4–6) og betennelsesaktige tykktarmsykdommer (7). Imidlertid er slimhinneklebing til magesekk og lunge fremdeles et kontroversielt tema, da det hersker usikkerhet om hvorvidt ønsket effekt oppnås.
Legemiddelbehandling av øyet er vanskelig, fordi virkestoffet blir raskt skylt bort. Noen kommersielt tilgjengelige slimhinneklebende preparater mot grønn stær er Pilocarpine gel (ikke tilgjengelig i Norge), Blocadren Depot og Timosan. Polymeren i okulære formuleringer vil i de fleste tilfeller ikke klare å forsinke frisettingen i tilfredstillende stor grad, i tillegg til at synet kan forstyrres. Det er derfor utviklet et kommersielt betaxolol preparat (Betoptic S), bestående av legemiddelpartikler som kan forsinke frisettingen, lagret i en slimhinneklebende polymer.
Mange av sykdommene nevnt tidligere kan angripe slimhinnene i vagina og munnhulen, og en del kommersielle preparater er derfor tilgjengelige (tabell 1). Siden vagina er selvrensende, er slimhinneklebende formuleringer ofte fordelaktige forå øke residenstiden til preparatet. Vaginale slimhinneklebende preparater fins mot sopp- og bakterieinfeksjon, så vel som prevensjonsmidler og fuktighetsgivere. Progesteronpreparatet i tabell 1 brukes mot nedsatt fruktbarhet og manglende menstruasjon. Det er et viktig alternativ til orale tabletter og injeksjoner, da progesteron er et steroid hormon, og tas derfor opp i liten grad i tarmen i tillegg til at det brytes ned. Det forventes at antall kommersielt tilgjengelige vaginale preparater vil øke, da det i 2006 ble rapportert om kliniske forsøk med seks ulike vaginale geler mot HIV, én mot human papilloma virus og et prevensjonsmiddel (8).
Tabell 1 viser at kommersielt tilgjengelige preparater til bruk i munnhulen inkluderer preparater mot smerte, betennelse, soppinfeksjon, desinfeksjonsmiddel og kunstig spytt. Orabase er en slimhinneklebende pasta som kan blandes med ulike legemidler. I 1947 ble Orabase blandet med penicillin; antakeligvis det første slimhinneklebende preparat som er beskrevet. Aphtach er en tablett som frisetter legemidlet bare fra én side, direkte til slimhinnen, uten tap til selve munnhulen. I 1984 ble professor Nagai tildelt Japan National Invention Prize for dette preparatet.
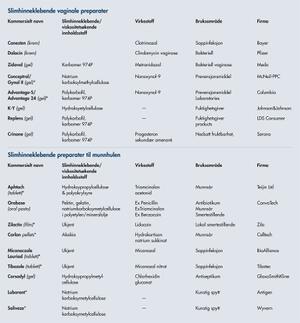
*Ikke kommersielt tilgjengelig i Norge.
Tabell 1. Kommersielt tilgjengelige slimhinneklebende preparater til lokal bruk i vagina og munnhulen. (Referanser: Ahuja et al., 1997, Rossi et al., 2005, Hussain et al., 2005, Valenta, 2005, das Neves and Bahia, 2006, Sudhakar et al., 2006 og das Neves et al., 2008)
Systemisk opptak
Det er vanlig at et virkestoff absorberes og utøver sin effekt systemisk ved transport i blodet. Mer enn 70 % av de mestselgende preparatene inntas peroralt og absorberes deretter fra slimhinnen i tynntarmen. Absorpsjonen er ofte høy fra tynntarmen, men for noen virkestoff er en lav absorpsjon en utfordring. Et annet problem er den høye enzymatiske aktiviteten i tynntarmen, som for eksempel kan føre til nedbrytning av virkestoffet. Dersom et virkestoff enten brytes ned og/eller i liten grad absorberes, blir den perorale biotilgjengeligheten lav (i noen tilfeller helt ned i cirka 30 %). Lav biotilgjengelighet kan også medføre at legemidlet bør injiseres. Ved å utnytte slimhinneklebing kan den peroral biotilgjengeligheten økes. Dette har blitt forsøkt for eksempel for paklitaxel, doxorubicin (cytostatika), ketoprofen, diklofenak (betennelsesnedsettende), karvedilol, diltiazen (hjerte-karmedisiner), cafadroxil, gentamycin (antibiotika), progesteron, testosteron (steroider), metformin, glipizid (glukosenedsettende), dopamin, buspiron (legemidler til hjernen) og budesonid, triamcinolon (kortikosteroider).
Virkestoff med kort halveringstid formuleres ofte for forsinket frisetting slik at administreringsfrekvensen kan reduseres. Eksempler er glipizid (antidiabetikum), felodipin og propanolol (blodtrykksnedsettende) og furosemid (diuretikum). Dersom virkestoffet ikke tas opp i hele tynntarmen eller tykktarmen, kan biotilgjengeligheten bli lav. I et slikt tilfelle vil en kombinasjon av forsinket frisetting og slimhinneklebing kunne øke biotilgjengeligheten. Et godt eksempel er furosemid, sombare absorberes fra øvre del av magetarmsystemet.
Nye fremskritt innen bio- og genteknologi har gjort det mulig å benytte peptider og proteiner (så vel som DNA, som omtales senere) som virkestoff, ofte med overlegen farmakologisk effekt, spesifisitet og lite bivirkninger. På grunn av nedbrytning og lavt opptak fra tarmen (grunnet høy vannløselighet og størrelse) vil peptider og proteiner som oftest injiseres, hvilket er en ulempe. Eksempler på terapeutisk aktive proteiner og peptider er humant vekst hormon, calcitonin, vasopressin og desmopressin, heparin og erytropoietin (EPO). Mest utbredt i bruk er insulin mot diabetes. Slimhinneklebing kan øke opptaket fra tarmen, men peptidet må samtidig beskyttes mot enzymatisk nedbrytning i lumen. Derfor har slimhinneklebende tarmplaster som kun frisetter insulin til slimhinnen, uten tap til lumen (9, 10), så vel som slimhinneklebende mikro- og nanopartikler som beskytter insulinet (11, 12), blitt beskrevet. Formuleringen kan inneholde substanser som øker permeabiliteten til epitelet (9), så vel som enzymhemmere (13) (for å øke stabiliteten til legemiddelet).
I en nylig publisert artikkel ble slimhinneklebende insulin nanopartikler administrert peroralt til rotter (14). Nivået av seruminsulin økte og relativ biotilgjengelighet sammenliknet med injeksjoner var 13,21 ± 1,42 %. Nivået av glukose ved faste ble redusert avhengig av insulindose og den glykemiske responsen til oral glukose ble forbedret over lang tid (fra to til cirka 12 timer). Nanopartiklene ble antakeligvis absorbert intakt, og fritt insulin frisatt fra partiklene ble ikke absorbert. Evnen til den kationiske slimhinneklebende polymeren til å åpne epitellaget og dermed øke absorpsjonen, så vel som nanopartiklenes beskyttelse av insulin i lumen, ble ansett som viktig i tillegg til slimhinneklebingen.
Til tross for ulike lovende resultater, er tynntarmen ikke det viktigste stedet for å utnytte slimhinneklebing. Så vidt forfatteren vet, fins det per i dag ingen produkter på markedet som er basert på dette prinsippet. Grunnen kan være at graden av slimhinneklebing som oppnås ofte er for lavt, for eksempel på grunn av den store væskemengden i tarmen. Tilstedeværelsen av mat og aktiv peristaltikk er også en kompliserende faktor. I tillegg kan tidlig nedbrytning i leveren være et stort problem for enkelte typer virkestoff, og dette kan ikke unngås ved å øke slimhinneklebingen.
Hoveddelen av forskningen konsentreres derfor på å oppnå slimhinneklebing i munnhulen. Det fins svært mange artikler som beskriver ulike virkestoff formulert for munnhulen, enten som gel, film, tablett, plaster eller pastill. Det anslås at markedsandelen til slimhinneklebende preparater til munnen øker i Amerika og Europa med en stabil vekstrate på over 10 % (15). Klebing på innsiden av kinnene kan benyttes ved behandling av kroniske sykdommer der forsinket frisetting er ønsket. Fordelen med munnhulen er at administreringen er lettere da formuleringen kan plasseres direkte på slimhinnen. Den enzymatiske aktiviteten er lavere enn i tarmen, og slimhinnen er robust og lite følsom for ødeleggelse. Dette kan være viktig i tilfeller der formuleringen inneholder en substans som øker permeabiliteten til epitelet, hvilket ofte er tilfellet, ettersom en av bakdelene med denne slimhinnen er lav permeabilitet sammenliknet med tarmen. På grunn av spyttsekresjon og svelging er residenstiden i munnhulen vanligvis kort, og slimhinneklebing er derfor fordelaktig.
Tabell 2 viser noen kommersielt tilgjengelige preparater til munnhulen. Glyseroltrinitrat brukes mot angina pectoris, og har nesten ingen peroral biotilgjengelighet (< 1 %), mens Suscard opplyses å gi en biotilgjengelighet på cirka 40 %. Prochlorperazin benyttes mot kvalme og oppkast og har også noe effekt mot migrene. En av fordelene i dette tilfellet er at det ved oppkast kan være problematisk å innta virkestoff peroralt. Fentanyl er et smertestillende av opoidtype med lav peroral biotilgjengelighet (cirka 30 %). Formuleringen til munnhulen dobler biotilgjengeligheten (cirka 65 %). Striant SR inneholder testosteron og brukes mot mannlig hypogonadisme. Det er en slimhinneklebende tablett med forsinket frisetting. Testosteron er ineffektivt peroralt, da det utsettes for enzymatisk nedbrytning i leveren (det er dermed også skadelig for leveren). Preparatet er et alternativ til intramuskulære injeksjoner (som kan føre til blodkonsentrasjoner over eller under det fysiologiske nivået), subkutane implantater (som er et mindre kirurgisk inngrep), transdermale plastre (som kan føre til hudirritasjon og oppleves som sosialt stigmatiserende) så vel som gel (der store områder av huden må dekkes, og man risikerer å overføre testosteron til en partner). Korbonits og medforfattere publiserte i 2004 en oversiktsartikkel som oppsummerte de viktigste kliniske dataene i utviklingen av Striant SR (16). De rapporterte at testosteronnivået i serum ble normalisert til fysiologisk nivå i løpet av fire timer etter bruk, at stabilt nivå ble oppnådd etter 24 timer når preparatet ble brukt to ganger daglig og at testosteronnivået økte til det normale nivået for 87–97 % av pasientene i fase III kliniske forsøk. De rapporterte også at preparatet ble godt tolerert og at bivirkningsfrekvensen var lav. Oralin er et unikt nålfritt insulinpreparat som også baserer seg på slimhinneklebing. Det er en vandig formulering, en oral spray som gis med et spesielt redskap til innsiden av kinnet. Insulinet er formulert i miceller, og preparatet inneholder i tillegg substanser som øker permeabiliteten til epitelet så vel som andre hjelpestoffer. Det kom på markedet i Ecuador i 2005 og i India i 2007, og kliniske forsøk igangsettes nå i USA og Europa som en del av markedsføringen.
Levering av virkestoff via neseslimhinnen har noen fordeler: som i munnhulen er slimhinnen lett tilgjengelig, nedbrytning av virkestoff i lever unngås, slimhinnen har god blodtilførsel og er ganske permeabel. Slimhinneklebing er ofte en fordel for nasale formuleringer, da den høye mukociliære aktiviteten vanligvis renser slimhinnen raskt. En ulempe med nasal administering er at metoden og teknikken for å applisere virkestoffet er mer utfordrende enn for eksempel i munnhulen. Nesen har blitt undersøkt for levering av terapeutiske peptider og proteiner, midler mot høyt blodtrykk (propranolol), steroider (progesteron), midler mot kvalme (metoclopramid), antibiotika (gentamicin) så vel som smertestillende av opoidtype (buprenorfin).
Det er vanligvis svært utfordrende å nå sentralnervesystemet gjennom den systemiske sirkulasjonen for et virkestoff, spesielt for peptider og proteiner. Grunnen til dette er tilstedeværelsen av blod-hjerne-barrieren og blod-cerebrospinalvæske-barrieren som beskytter sentralnervesystemet mot potensielt giftige og skadelige substanser. Luktelappen (olfactory region) i nesen er den eneste delen av sentralnervesystemet som er i direkte kontakt med omgivelsene. Via luktelappen kan virkestoff gå direkte fra nesen tilsentralnervesystemet og unngå de to barrierene. Dette kan utnyttes for eksempel ved behandling av Parkinsons og Alzheimers sykdommer. Imidlertid er mengden virkestoff som kan transporteres på denne måten liten da luktelappen kun opptar 5 % av det totale arealet i nesen, og området er vanskelig å treffe. I en studie ble ulike formuleringer av takrin forsøkt levert til hjernen via luktelappen (17): Takrin er det første legemiddelet godkjent av FDA, i 1993, for behandling av symptomer på Alzheimers sykdom. Det er en kolinesterasehemmer som også er godkjent av EMEA. Distribusjonen etter intravenøs og intranasal administrering av radioaktiv takrin har blitt målt i mus. Naturlig nok ble høyere radioaktivitet gjenfunnet i blodet ved intravenøs administrering sammenliknet med intranasal administrering. Radioaktivitet i hjernen var derimot høyere ved intranasal administrering. Hjernebiotilgjengeligheten for en slimhinneklebende mikroemulsjon var omtrent dobbelt så høy som for takrin løsning. I tillegg var hjernebiotilgjenglighet høyere for en slimhinneklebende mikroemulsjon sammenliknet med vanlig mikroemulsjon. Dette illustrerte den positive effekten av slimhinneklebing. I tillegg ble det målt raskere bedring av hukommelsestap i skopolamin indusert søvnige mus når den slimhinneklebende formuleringen ble benyttet. Lokalisering av virkestoff til hjernen ble også bekreftet i kaniner ved å benytte gamma scintigrafi. Den samme gruppen har også levert risperidon på samme måte (18). Risperidon er et godkjent middel mot psykose.
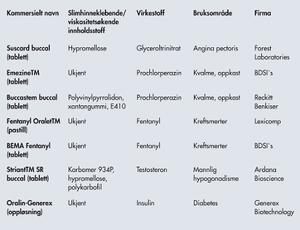
Tabell 2. Kommersielt tilgjengelige slimhinneklebende preparater til munnhulen, for systemisk bruk. NB! Ingen av disse preparatene er kommersielt tilgjengelige i Norge. (Referanser: Rossi et al., 2005, Sudhakar et al., 2006 og Khafagy et al., 2007.)
Levering av DNA og slimhinnevaksinering
Selv om tradisjonell systemisk vaksinasjon har vært, og er en suksess, fins det noen fordeler relatert til slimhinnevaksinering: Det er et nålfritt alternativ som reduserer kostnadene og nødvendigheten av å ha høyt kvalifisert helsepersonell til stede, noe som generelt er et hinder for mer utbredt vaksinering på verdensbasis. Dette er viktig, særlig siden WHO anslår at mer enn to millioner mennesker dør årlig på grunn av sykdommer som lett kan forhindres med vaksine, cirka halvparten av disse er barn under fem år. Slimhinnevaksinering involverer lymfeorganene i tarmen, respirasjonssystemet (nese og lunger) så vel som urogenital systemet. Ved slimhinnevaksinering vil, i tillegg til systemisk immunitet, også slimhinneimmunsystemet aktiveres. Dette har flere fordeler. Én fordel er at et aktivt slimhinneimmunsystem ofte vil kunne beskytte kroppen på et tidlig tidspunkt i infeksjonsforløpet hvor mange mikrober vil angipe kroppen via slimhinnene. Derfor kreves også mindre antigen for å oppnå slimhinneimmunitet sammenliknet med systemisk immunitet. En annen fordel er at slimhinneimmunsystemet er felles, noe som betyr at dersom én av disse slimhinnene vaksineres vil det resultere i full slimhinneimmunitet. Dermed kan vaksiner mot ulike typer mikrober utvikles (eksempelvis kikhoste, Salmonella, stivkrampe, kolera, Helicobacter pylori, hepatitt B, difteri, human papilloma virus, hjernehinnebetennelse, tuberkulose, HIV, influensaog meslinger), og gis valgfritt via én av slimhinnene. En annen mulighet er oral toleranse: dersom et antigen gis oralt, kan det oppstå en understimulering av systemisk respons. Dette kan benyttes for behandling av hyperrespons (eksempelvis matallergi, kommensale bakterier, autoimmune sykdommer (encefalomyelitt, reumatoid artritt, diabetes) og ved transplantasjoner).
DNA vaksiner representerer et nytt alternativ til tradisjonelle vaksiner. Mens tradisjonelle vaksiner kan være døde eller inaktiverte organismer, eller rensede produkter fra dem, fungerer DNA vaksinering ved å bruke vertceller til å produsere det plasmid kodede antigenet. Antigenet presenteres så for immunforsvaret på en tilsvarende måte som ved naturlige infeksjoner. Dette er samme prinsipp som levering av gener generelt (selv om målet i enkelte tilfeller også kan være systemisk opptak), og de samme metodene kan derfor benyttes. Hensikten med levering av gener er å indusere en vedvarende produksjon av terapeutisk protein lokalt på sykdomsstedet i magetarmsystemet, for eksempel i tilfeller av mage- eller tolvfingertarmsår, betennelsesaktige tykktarmsykdommer, infeksjoner i magetarmsystemet eller tykktarmskreft. En fordel med DNA-basert slimhinnevaksinering er at i tillegg til indusert humoral respons, induseres også cellulær respons som kan benyttes terapeutisk. DNA vaksiner kan derfor også utvikles mot kreft. Slimhinneklebing vil øke residenstiden og dermed effekten av DNAet. Imidlertid er det viktig at DNAet også beskyttes tilfredsstillende mot nedbrytning. Fordelen med økt residenstid på DNA transfeksjon og proteinproduksjon har blitt illustrert (19). Gelatin nanopartikler med innhold av plasmid DNA (som kodet for et grøntfluorescerende protein) ble sammenliknet med et system kalt NiMOS, der de samme gelatin partiklene var lagret i en beskyttende mikrosfærematrix. NiMOS forble lenger i magen og tynntarmen etter oral administrering i rotter. Gelatin partiklene førte ikke til fluorescens, i motsetning til NiMOS der fluorescensen var tydelig etter fem dager, hvilket tydet på proteinproduksjon. En ulempe med forsøksoppsettet i denne studien var at effekten av økt stabilitet og økt residenstid ikke kunne skilles fra hverandre. I tillegg er det uklart om protein produksjonen var høy nok til å kunne gi terapeutisk eller vaksinasjonseffekt. Da studien var utført i rotter, er effekten i mennesker fremdeles uviss.
I en studie i mus ble en konvensjonell hepatitt B vaksine gitt intramuskulært, og sammenliknet med DNA liposomer med og uten slimhinneklebende egenskaper, gitt via nesen (20). Den konvensjonelle vaksinen gav høy systemisk respons, men ingen slimhinneimmunrespons. Dette var i motsetning til de slimhinneklebende DNA liposomer gitt via nesen som gav en slimhinneimmunrespons som var vesentlig høyere enn for DNA liposomer uten slimhinneklebende egenskaper. Selv om den positive effekten av slimhinneklebing ble illustrert, så har mus et slimhinneimmunsystem som er ulikt menneskers. Til tross for at antistoffer ble detektert, er det ennå uklart om mengden var stor nok til å nedkjempe viruset.
KONKLUSJON
Alle slimhinner kan utnyttes av klebende formuleringer, både for å bedre effekten ved lokal behandling av sykdomstilstander, for å øke systemisk biotilgjengelighet av virkestoff, for å levere DNA og ved slimhinnevaksinering. Selv om de terapeutiske fordelene kan være store, er klinisk bruk fremdeles beskjeden. Grunner til dette kan væremanglende kliniske data, spesielt i mennesker, sikkerhetsaspekter, særlig i tilfeller der nanopartikler og substanser som øker permeabiliteten til epitelet, benyttes samt høye kostnader. Andre begrensninger er at slimhinneklebing generelt er en uspesifikk adhesjon, det er en mulighet for at formuleringen og virkestoffet festes i slimlaget uten å nå epitelet og at tiden kroppen bruker på å fornye slimlaget vil være avgjørende for residenstiden som kan oppnås.
Oppgitte interessekonflikter: Ingen
Referanser
- Tzachev C T, Mandajieva M, Minkov E H et al. Comparison of the clinical efficacy of standard and mucoadhesive-based nasal decongestants. Br J Clin Pharmacol 2002; 53: 107–09.
- Sakagami M, Kinoshita W, Sakon K et al. Mucoadhesive beclomethasone microspheres for powder inhalation: their pharmacokinetics and pharmacodynamics evaluation. J Control Release 2002; 80: 207–18.
- Manca M-L, Mourtas S, Dracopoulos V et al. PLGA, chitosan or chitosan-coated PLGA microparticles for alveolar delivery? A comparative study of particle stability during nebulization. Colloids Surf B Biointerfaces 2008; 62: 220–31.
- Ramteke S, Jain N K Clarithromycin- and omeprazole-containing gliadin nanoparticles for the treatment of Helicobacter pylori. J Drug Target 2008; 16: 65–72.
- Chun M-K, Sah H, Choi H-K Preparation of mucoadhesive microspheres containing antimicrobial agents for eradication of H. Pylori International Journal of Pharmaceutics 2005; 297: 172–79.
- Higo S, Ori K, Takeuchi H et al. A Novel Evaluation Method of Gastric Mucoadhesive Property in Vitro and the Mucoadhesive Mechanism of Tetracycline-Sucralfate Acidic Complex for Eradication of Helicobacter pylori. Pharm Res 2004; 21: 413–19.
- Tuğcu-Demiröz F, Acartürk F, Takka S et al. Evaluation of alginate based mesalazine tablets for intestinal drug delivery. Eur J Pharm Biopharm 2007; 67: 491–97.
- das Neves J, Bahia M F Gels as vaginal drug delivery systems. International Journal of Pharmaceutics 2006; 318: 1-14.
- Whitehead K, Shen Z, Mitragotri S Oral delivery of macromolecules using intestinal patches: applications for insulin delivery. J Control Release 2004; 98: 37–45.
- Grabovac V, Föger F, Bernkop-Schnürch A Design and in vivo evaluation of a patch delivery system for insulin based on thiolated polymers. International Journal of Pharmaceutics 2008; 348: 169–74.
- Sarmento B, Ribeiro A, Veiga F et al. Alginate/Chitosan Nanoparticles are Effective for Oral Insulin Delivery. Pharm Res 2007; 24: 2198–206.
- Sarmento B, Ribeiro A, Veiga F et al. Oral Bioavailability of Insulin Contained in Polysaccharide Nanoparticles. Biomacromolecules 2007; 2007: 3054–60.
- Marschütz M K, Caliceti P, Bernkop-Schnürch A Design and In Vivo Evaluation of an Oral Delivery System for Insulin Pharm Res 2000; 17: 1468–74.
- Damgé C, Maincent P, Ubricht N Oral delivery of insulin associated to polymeric nanoparticles in diabetic rats. J Control Release 2007; 117: 163–70.
- Sudhakar Y, Kuotsu K, Bandyopadhyay A K Buccal bioadhesive drug delivery – A promising option for orally less efficient drugs. J Control Release 2006; 114: 15–40.
- Korbonits M, Kipnes M, Grossman A B Striant SR: A novel, effective and convenient testosterone therapy for male hypogonadism. Int J Clin Pract 2005; 58: 1073–80.
- Jogani V V, Shah P J, Mishra P et al. Intranasal mucoadhesive microemulsion of tacrine to improve brain targeting. Alzheimer Dis Assoc Disord 2008; 22: 116–24.
- Kumar M, Misra A R, Babbar A K et al. Intranasal nanoemulsion based brain targeting drug delivery system of risperidone. Int J Pharm 2008; 358: 285–91.
- Bhavsar M D,Amiji M M Gastrointestinal distribution and in vivo gene transfection studies with nanoparticles-in-microsphere oral system (NiMOS). J Control Release 2008; 119: 339–48.
- Khatri K, Goyal A K, Gupta P N et al. Surface modified liposomes for nasal delivery of DNA vaccine Vaccine 2008; 26: 2225–33.
Manuskriptet ble mottatt 30. juli 2008 og godkjent 10. november 2008. Fagredaktør Ingunn Tho.
Norsk Farmaceutisk Tidsskrift 2008; 12: 32–6.
