Tre Echinacea-arter har ulike innholdsstoffer og biologisk aktivitet
Sammendrag
Slekten Echinacea består av ni arter, tre av disse forbindes med tradisjonell bruk. Det er Echinacea purpurea (L.) Moench, Echinacea angustifolia (DC.) Hell. og Echinacea pallida (Nutt.) Nutt. Echinacea-preparater brukes også i dag mye profylaktisk eller terapeutisk ved vanlig forkjølelse, ved influensa eller andre infeksjoner i øvre luftveier. Preparater som er på markedet er for det meste pressaft av E. purpurea, overjordisk del, eller alkoholekstrakter (oftest ca. 50 %) av alle deler av E. purpurea. I tillegg finnes alkoholekstrakter av røtter fra E. pallida eller E. angustifolia. Ved vurderinger av kliniske studier er det viktig å være klar over at de tre Echinacea-artene har forskjellige innholdsstoffer, innholdsstoffene varierer med hvilken plantedel som benyttes og i tillegg vil typer og mengde innholdsstoffer avhenge av ekstraksjonsbetingelsene. De innholdsstoffene i Echinacea som oftest assosieres med biologisk aktivitet er polysakkarider, glykoproteiner, kaffesyrederivater og alkamider. Artikkelen presenterer en oppdatert vurdering av plantenes innhold av kjemiske substanser, og det blir lagt vekt på disse substansenes biologiske aktivitet, spesielt de immunmodulerende egenskaper.
Hovedbudskap
Echinacea (solhatt)-preparater innholder store variasjoner når det gjelder type og mengde aktive innholdsstoffer.
Ved bedømmelse og sammenlikning av kliniske studier må det legges vekt på det benyttede preparats innholdsstoffer og disse må vurderes mot eventuell aktivitet.
Summary
Three Echinacea species with different content of chemical constituents and with similar but not identical biological activity.
Of the nine existing Echinacea species, three have been much used medicinally. They are Echinacea purpurea (L.) Moench, Echinacea angustifolia (DC.) Hell. and Echinacea pallida (Nutt.) Nutt. Current interest in the medicinal use of Echinacea is concentrared on its immunomodulatory effects, particularly in the treatment and prevention of common cold, influenza and other respiratory tract infections. Most of the commercial preparations contain the expressed sap of E. purpurea aerial parts, hydroalcoholic tinctures of the whole plant of E. purpurea or hydroalcoholic tinctures of either E. pallida or E. angustifolia roots. It is important to distinguish between the different species, parts of the plants and the various extraction modes. It is very important to be aware of the differences in the chemical constituents when evaluating clinical studies. The compounds regarded as active include polysaccharides, glycoproteins, caffeic acid derivatives and alkamides. An updated review of the chemical constituents of the three species and the biological and immunomodulatory activity of these substances will be presented.
Figurer
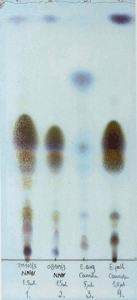
Figur 1. Tynnsjiktskromatografi
Eterisk olje
1) E. angustifolia NNN Batch 8M150/3
2) E. angustifolia NNN Batch 0B109/3
3) E. angustifolia, Standard
4) E. pallida, Standard

Figur 2. Tynnsjiktskromatografi
Metanolekstrakt, hydrofile komponeter
1) E. angustifolia NNN Batch 8M150/3
2) E. angustifolia NNN Batch 0B109/3
3) Cynarin
4) E. angustifolia, Standard
5) E. pallida, Standard
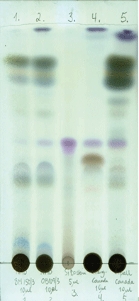
Figur 3.
Tynnsjiktskromatografi
Metanolekstrakt, lipofile komponenter
1) E. angustifolia NNN Batch 8M150/3
2) E. angustifolia NNN Batch 0B109/3
3) ß-sitosterin
4) E. angustifolia, Standard
5) E. pallida, Standard
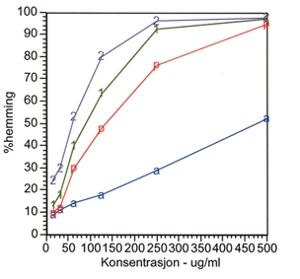
Figur 4. Komplementfikseringsaktivitet
50°C vannekstrakt
1) E. angustifolia NNN Batch 8M150/3
2) E. angustifolia NNN Batch 0B109/3
a) E. angustifolia, Standard
p) E. pallida, Standard
Last ned hele artikkelen i pdf-format.
INNLEDNING
Echinacea (solhatt) er fortsatt av de mest populære og bestselgende medisinplanter i den industrialiserte verden. Slekten består av ni arter, tre av disse forbindes med tradisjonell bruk. Det er Echinacea purpurea (L.) Moench (purpursolhatt), Echinacea angustifolia (DC.) Hell. (smalbladet solhatt) og Echinacea pallida (Nutt.) Nutt (blek solhatt).
Nordamerikanske indianere var de første som brukte Echinacea medisinsk. Bruk av rot fra E. pallida og fra E. angustifolia rundt 1850 er dokumentert og den første offisielle monografi i «The National Formulary of the US» kom i 1916. Bruk av Echinacea purpurea overjordisk plantedel (herba) og rot (radix) er av atskillig nyere dato (midten av det 20. århundre), og E. purpurea herba er den plantedelen som er desidert mest studert (Bauer, 1998).
Det har i de siste årene kommet mange meta-analyser og oversiktsartikler som hevder at Echinacea-preparater har, eller ikke har, effekt mot infeksjoner i øvre luftveier. Hvorfor er det fortsatt interesse for bruk av disse preparatene? Bare i USA regner man med at det er rundt en milliard sykdomstilfeller av vanlig forkjølelse i året, noe som resulterer i høyt fravær fra jobb og skole (Shah et al., 2007). Forholdene er sannsynligvis ikke så ulike andre steder, og det er innlysende at en reduksjon av antall sykdomstilfeller og sykedager er samfunnsøkonomisk gunstig. Det er beregnet at et årlig salg av Echinacea-produkter (alkohol-tinkturer, vandige alkoholekstrakter, pressaft, tabletter, pastiller, kapsler etc.) i hele verden er på ca. 300 millioner dollar.
Søker man etter Echinacea i databaser finner man (januar 2009) 701 artikler i Medline, som dekker medisinske forskningsartikler, og 2093 i SciFinder, som dekker både medisinsk og kjemisk forskningslitteratur (av disse var 659 patenter). Den første registrerte artikkel i SciFinder er fra 1883, og i de senere år har det blitt publisert ca. 200 per år. Det er for en stor del in vitro-studier på celler fra dyr og mennesker (eventuelt ex vivo-studier) og in vivo-studier i dyremodeller. Det er mange rapporter som viser at Echinacea-ekstrakter har immunmodulerende egenskaper. Utvalgte artikler funnet i de nevnte databaser og enkelte kapitler fra bøker danner grunnlaget for denne oversiktsartikkelen.
Intensjonen med artikkelen er å belyse variasjoner av innholdsstoffer i de forskjellige Echinacea-arter og disse substansenes immunmodulerende egenskaper, noe man må ta hensyn til når man skal bedømme mulige kliniske effekter.
Innholdsstoffer og aktivitet
De innholdsstoffene i Echinacea som oftest assosieres med biologisk aktivitet er polysakkarider, glykoproteiner, kaffesyrederivater og alkamider. Andre innholdsstoffer er ketoalkener, ketoalkyner, eterisk olje (diverse terpener), alkaloider, flavonoider og flere.
Polysakkarider og glykoproteiner
Polysakkarider var de første substansene i Echinacea-artene som ble vist å ha immunmodulerende effekt. Innhold og aktivitet av polysakkarider og glykoproteiner i forskjellige Echinacea-arter er vist i tabell 1.
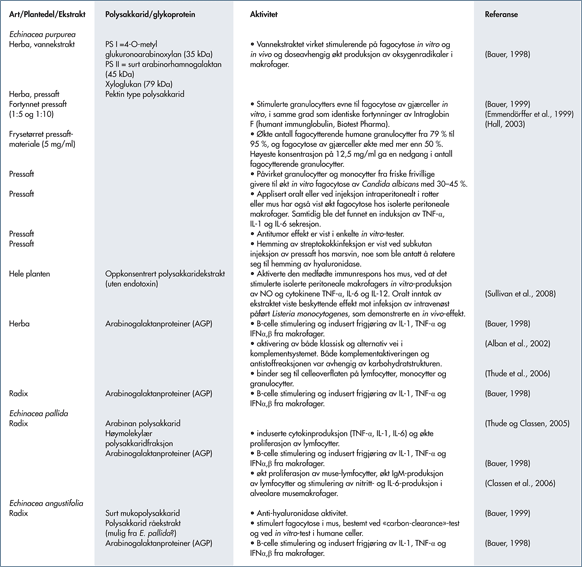
Tabell 1. Innhold og aktivitet av polysakkarider og glykoproteiner i forskjellige Echinacea-arter.
De fleste biologiske aktivitetsstudiene på overjordisk plantedel av E. purpurea er utført på pressaft. En pressaft av plantemateriale innholder de vannløseligesubstanser som polysakkarider/glykoproteiner og ikke så mye av kaffesyrederivater og upolare (lipofile) substanser som alkamider og acetylener. Dette er en type preparat som har vært i handelen i Tyskland i 70 år. Preparat med pressaft av Echinacea purpurea (Echinagard®) har vært i handelen som naturlegemiddel i Norge. Det er nødvendig å nevne at disse preparatene inneholder 22 % etanol for konservering og ikke er, som noen tror, et spritekstrakt.
Sullivan og medarbeidere (2008) har undersøkt mekanismen for hvordan et polysakkaridholdig E. purpurea ekstrakt, uten innhold av endotoxin (EP) induserte makrofagaktivering. E. coli lipopolysakkarid (LPS) ble brukt som positiv kontrollsubstans. Både LPS og EP stimulerte makrofagproduksjonen av cytokinene TNF-α, IL-6 og IL-12. IL-1β er et potent proinflammatorisk cytokin som produseres av makrofager ved en bakterieinfeksjon. Som forventet stimulerte LPS makrofagsekresjon av IL-1β, mens EP gjorde det ikke. Dette var uventet fordi produksjon av alle de nevnte cytokinene reguleres av samme transkripsjonsfaktor NF-ĸB. Det ble også vist at en LPS-inhibitor (Polymyxin B) hemmet LPS-aktivering av makrofager, men hemmet ikke EP-aktivering av makrofagene. LPS aktiverer makrofager via TLR4-avhengige mekanismer. «Toll-like receptors» (TLR) er reseptorer som spiller en viktig rolle ved patogengjenkjenning og aktivering av det medfødte immunsystem. I dette arbeidet ble det vist at EP hadde komponenter som initierte aktivitet via både TLR4-avhengige og -uavhengige mekanismer, og at komponenter i EP initierte aktivering av makrofager via TLR2. Videre at EP induserte celleaktivitet via tre «mitogen-activated protein kinase» (MAPK) veier. I tillegg viste de at EP aktiverte transkripsjonsfaktor NF-ĸB, som har en nøkkelrolle i reguleringen av proinflammatorisk immunrespons ved en infeksjon.
Arabinogalaktanproteiner inneholder ≥90 % karbohydrat og ≤10 % protein. Classen (2005) har vist at monoklonalt antistoff (kanin) mot karbohydratdelen av AGP fra pressaft av E. purpurea herba, ga lav kryssreaksjon med AGP fra E. pallida og ingen kryssreaksjon med AGP isolert fra E. purpurea-cellekultur eller arabisk gummi (som også er et arabinogalaktan). Dette tydeliggjør at selv om mengdeforholdet av monosakkarider i disse AGPene er svært like, så er det ulikheter i polysakkaridstrukturen.
Det er dessuten funnet rikelige mengder med inulin og fruktooligosakkarider i røttene fra alle tre artene (Bauer, 1999). Det er som forventet da det er relativt vanlig at røtter inneholder dette som sin opplagsnæring. Fruktooligosakkarider er forbundet med prebiotisk effekt (Manzanares og Hardy, 2008).
Kaffesyrederivater
Det finnes mange forskjellige fenoliske substanser i Echinacea-artene. De kaffesyrederivatene det er vanligst å diskutere i forbindelse med Echinacea er echinacosid, verbascosid, cynarin, klorogensyre og sikorisyre. Sikorisyre finnes rikelig i E. purpurea blomst og rot, men bare i spormengder i E. pallida rot og ikke noe i E. angustifolia rot. Echinacosid er det kaffesyrederivat det finnes mest av i E. angustifolia og E. pallida røtter, mens det ikke finnes noe echinacosid i E. purpurea. Cynarin finnes bare i E. angustifolia røtter. Disse kaffesyrederivatene kan altså bidra til identifisering av Echinacea-art. Sikorisyre er ustabil under preparering, dette skyldes sannsynligvis enzymatisk degradering (Hall, 2003); sikorisyren er mye mer stabil når plantematerialet er filtrert fra.Tidsaspektet for degradering er avhengig av blant annet ekstraksjonsmiddel og temperatur. Det er sannsynlig at pressaft inneholder enzymer, noe som antas å være grunnen til at det ofte finnes lite sikorisyre i disse preparatene. Dette viser hvor viktig det er med vel definerte ekstraksjonsbetingelser. Wu og medarbeidere (2008) viser at de får optimalt utbytte av kaffesyrederivater som kaftarsyre, klorogensyre og sikorisyre ved å ekstrahere plantematerialet, i dette tilfellet røtter fra E. purpurea, med 60 % etanol ved 60°C. Det bør også nevnes at innhold av kaffesyrederivater i plantematerialet varierer en god del med årstiden. Man finner høyere konsentrasjoner tidlig i blomstringsfasen enn mot slutten av vekstfasen.
Det kan også nevnes at kaffesyrederivater som forventet, på grunn av fenolisk struktur, har antioksidant effekt. I tillegg til å vise at sikorisyre og echinacosid har høy antioksidant effekt, viste Dalby-Brown og medarbeidere (2005) at å blande disse kaffesyrederivatene med isolerte alkamider og isolerte polysakkaridfraksjoner fra E. purpurea røtter, ga en signifikant høyere antioksidant aktivitet enn summen av hver av komponentenes aktivitet (synergieffekt). Sikorisyre har vist stimulering av fagocytose in vitro og in vivo, mens echinacosid og verbascosid viste lav effekt. Videre har sikorisyre og echinacosid vist hemming av hyaluronidase og evne til å beskytte collagen type III mot fri radikal indusert degradering (preventivt forhindre hudskader ved soling) (Bauer, 1998, Bauer, 1999, Speroni et al., 2002). Sikorisyre viste en antiviral aktivitet mot Herpes simplex Virus (HSV-I), og et 70 % etanolekstrakt av E. pallida rot viste enda høyere aktivitet i det samme systemet (Binns et al., 2002). Sikorisyre har vist seg å selektivt hemme enzymet HIV-1 integrase in vitro (Reinke et al., 2004). Dong og medarbeidere (2009) har vist at cynarin har et potensiale som immunsupressivt middel, fordi cynarin blokkerer interaksjonen mellom membranmarkørene CD28 på T-celler og CD80 på B-celler (signal 2).
Alkamider
Alkamider er umettede N-alkylamid lipider og ekstraheres ofte fra plantematerialet med n-hexan eller superkritisk CO2. Det vil også finnes noe alkamider i et 60 % spritekstrakt. Det er markante ulikheter i innhold av alkamider i de tre Echinacea-artene. Rotdrogen av E. pallida inneholder så godt som ikke noe alkamider. Den lipofile hovedkomponent her er ketoalkener og ketoalkyner. Rotdroge av E. angustifolia og både rot- og herbadroge av E. purpurea innholder alkamider, men det er forskjell i grad av dobbeltbindinger. E. angustifolia har hovedsakelig en fordeling av 2-monoen alkamider, mens E. purpurea har hovedsakelig en fordeling av 2,4-dien alkamider. Men begge har dodeca-2E,4E,8Z,10E/Z-tetraensyre isobutylamid som alkamid hovedkomponent (Bauer, 1999). Dette betyr at analyse av alkamidene kan bidra til å skille mellom de tre Echinacea-artene.
I de senere år har det vært stor interesse for alkamiders biologiske aktivitet. Det er gjort mange studier som viser at alkamider har immunmodulerende egenskaper. Flere tidlige studier har vist at alkamider gir stimulering av fagocytose (Bauer, 1999). Det er vist antiviral effekt mot Herpes simplex, og hemming av cyclooksygenase og 5-lipoksygenase. Gertsch og medarbeidere (2004) fant at isolerte alkamider induserte oppregulering av TNF-α mRNAi monocytter/makrofager, men fant ikke økt produksjon av TNF-α. I tillegg fant de at disse alkamidene ga en hemming av LPS (endotoksin) indusert produksjon av TNF-α protein, og at reguleringen blant annet skjedde via cannabinoid reseptor CB2. Det er senere vist at alkamider har strukturlikheter med anandamid, en endogen ligand for cannabinoid reseptorer, og at de binder seg med høy affinitet til CB2 reseptoren, noe som kan være en årsak til immunmodulerende evne (Woelkart et al., 2008). Matthias og medarbeidere (2008) har vist at to forskjellige typer alkamider (2-en alkylamid og 2,4-dien alkylamid) gir motsatt effekt på transkripsjonsfaktor NF-ĸB som regulerer proinflammatorisk immunrespons ved infeksjon.
Det er også vist at alkamider både absorberes fra munn og svelg og fra mage-tarmkanalen (Woelkart et al., 2005). Blodkonsentrasjonen av alkamider øker raskere ved inntak av flytende ekstrakt enn ved inntak av tabletter/drops, men opptaket er høyt ved begge preparattyper (Guiotto et al., 2008). Guiotto fant også at et alkamidekstrakt fra E. purpurea rot gitt til seks friske frivillige menn og kvinner, ga en ikke-doseavhengig reduksjon i plasmakonsentrasjonen av proinflammatoriske cytokiner IL-12p70, IL-8, IL-6, TNF-α og anti-inflammatorisk cytokin IL-10.
Ketoalkener og ketoalkyner
I forhold til de andre kategoriene av innholdsstoffer er det gjort få aktivitetsstudier på ketoalkener og ketoalkyner fra Echinacea. Lipofilt, nhexan, ekstrakt av de tre Echinacea-artene inneholder forskjellige mengder av disse. Mens E. pallida rotekstrakt inneholder mest ketoalkener og ketoalkyner, inneholder E. purpurea rotekstrakt og E. angustifolia rotekstrakt alkamider som lipofile hovedkomponenter. Ketoalkener og ketoalkyner fra E. pallida har vist en cytotoksisk effekt på humane cancerceller fra pankreas og colon (Chicca et al., 2008). Spesielt var det pentadeca-(8Z,13Z)-dien-11-yn-2-one som hadde den høyeste doseavhengige aktiviteten. Ved å benytte Caco-2 celler (monolayer permeabilitet) ble det også vist at disse substansene sannsynligvis har høy biotilgjengelighet.
Innholdsstoffer i blanding
Sikorisyre, polysakkarider og alkamider isolert fra E. purpurea, blandet i forholdet 40:1000:4 og gitt oralt til rotter, viste stimulering av makrofag funksjonen i lunger og milt på en doseavhengig måte (Goel et al., 2002).
Et Echinacea angustifolia rot-ekstrakt inneholdende >4 % echinacosid, >5 % polysakkarider/glykoproteiner og <0,1 % alkamider, har vist økt T-celle funksjon in vitro og senket Candida albicans indusert dødelighet for normale og cyclosporin-A behandlede mus (Morazzoni et al., 2005).
Pillai og medarbeidere (2007) har vist at humane leukocytter ex vivo ble sterkt stimulert til proliferasjon og til å produsere immunstimulering og proinflammatoriske cytokiner ved påvirkning med forskjellige ekstrakter fra de tre Echinacea-artene. De viste dessuten at vannløselige substanser var sterkere immunmodulatorer enn de lipofile lavmolekylære komponentene. De diskuterte biotilgjengeligheten av de forskjellige substansene, og minnet om mulig påvirkning på lymfoid vev og antigen-presenterende dendritiske celler som finnes i epitelcellene i mage-tarmkanalen (også i munnhulen).
Et rotekstrakt av hver av de tre Echinacea-artene ble sammenliknet i forhold til påvirkning på det medfødte og selektive immunsystem hos mus. Rotekstraktene hadde arts-spesifikt innhold av alkamider og kaffesyrederivater, der E. angustifolia ekstraktet inneholdt 10,2 % alkamider og 0,6 % kaffesyrederivater (mest echinacosid og noe mindre cynarin), E. pallida ekstraktet inneholdt 1,8 % alkamider og 1,1 % kaffesyrederivater (mest echinacosid og noe klorogensyre) og E. purpurea ekstrakt inneholdt 8,0 % alkamider og 0,8 % kaffesyrederivater (mest sikorisyre). Mus fikk tilført et av ekstraktene eller tilsvarende blindprøve via sonde til magen en gang per dag i sju dager og ble immunisert med røde blodceller fra sau (sRBC) fire dager før innsamling av immunceller. De tre drogene produserte liknende, men likevel forskjellig effekt på immuncellepopulasjonen og cellenes biologiske funksjon, inkludert økt prosentvis mengde CD49+ og CD19+ lymfocytter i milt og økt NK («natural killer») celle cytotoksitet. Alle tre ekstrakter økte antistoff responsen mot sRBC. LPS-stimulerte milt-lymfocytter fra E. angustifolia- og E. pallida-behandlet mus viste en signifikant økning i T-celle proliferasjon. I tillegg ble det vist at Echinacea-behandling førte til en endret cytokinproduksjon i LPS-aktiverte milt-lymfocytter. Ekstraktene førte til økt interferon-γ produksjon, men hemmet frigjøring av TNF-α og IL-1β fra LPS-stimulerte makrofager. Bare E. angustifolia og E. pallida viste økt produksjon av IL-4 og Il-10 (Zhai et al., 2007).
Et stort antall studier som viser immunmodulerende, antiviral, antifungal, antibakteriell, anti-inflammatorisk, sårhelende og annen aktivitet er utført på ekstrakter der innholdsstoffer ikke er angitt. Disse studiene er ikke kommentert.
Forvekslinger
Det er relativt godt kjent at det opp gjennom tiden har vært solgt en del E. pallida deklarert som E. angustifolia (Bauer, 1998). Fagmiljøet farmakognosi ved Farmasøytisk institutt, har erfart dette. Innkjøpt Echinacea angustifolia ble undersøkt ved tynnsjiktskromatografi etter metoder publisert i den europeiske farmakopé (European Pharmacopoeia, vol 1: 251-252) og i «Plant drug analysis» (Wagner og Bladt, 1996), og sammenliknet med sertifisert standard plantemateriale av E. angustifolia og E.pallida. Figur 1, 2 og 3 viser tynnsjiktskromatografi av henholdsvis eterisk olje, hydrofile komponenter og lipofile komponenter. Det er kjent fra litteraturen at E. angustifolia inneholder mindre enn 0,1 % eterisk olje, mens E. pallida inneholder mer enn 2 %. Komponenter i oljen fra det innkjøpte plantematerialet sammenfaller med komponenter i oljen fra sertifisert standard E. pallida. Det er også kjent at E. angustifolia inneholder godt påviselige mengder med cynarin, mens E. pallida inneholder så små mengder av denne substansen at det må svært følsomme metoder til for å påvise den. Innkjøpt plantemateriale inneholdt ikke påvisbare mengder med cynarin. Figur 3 viser at E. pallida har mange flere lipofile komponenter enn E. angustifolia i dette systemet. De tynnsjiktskromatografiske metodene viser tydelig at de to rotdrogene inneholder mange ulike innholdsstoffer som gir mulighet for identifikasjon, men som også kan forklare forskjell i påvirkning på immunologiske parametre. Det innkjøpte plantematerialet «E. angustifolia» var i dette tilfellet E. pallida. Figur 4 viser at 50°C vannekstrakt av de samme planteprøver har forskjellig påvirkning på komplement i en komplementfikseringstest beskrevet av Michaelsen og medarbeidere (2000). Figuren viser at dette vannekstraktet fra E. pallida har større påvirkning på komplementsystemet ved lavere konsentrasjoner enn tilsvarende vannekstrakt fra E. angustifolia. Forsøket viser én type ekstrakt i en testmetode, og betyr ikke at den ene planten er mer effektiv i forhold til for eksempel forkjølelse. Men det viser igjen at de to rotdrogene er ulike og har ulik aktivitet i en biologisk testmetode.
Kliniske studier
Flere hundre kliniske studier på Echinacea er utført gjennom tidene, noen viser effekt ved øvre luftveisinfeksjoner og andre ikke. De fleste viser positiv effekt, men studiene er ofte av dårlig kvalitet. Man antar også at det er en del underrapportering av negative resultater.
Raknes og Småbrekke mener i en oversikt (2006) at Echinacea hverken har noen effekt ved forbygging eller behandling av øvre luftveisinfeksjoner, og at det ikke er faglig eller økonomisk grunnlag for å gjennomføre flere studier. Raknes og Småbrekke legger mye vekt på en klinisk studie utført av Turner og medarbeidere (2005). Dette er en studie der friske frivillige som var eksperimentelt eksponert med rhinovirus, ble behandlet med ekstrakter av E. angustifolia. Studien viser ingen signifikant effekt. Raknes sier dette er den største og metodologisk mest robuste kliniske utprøvningen av Echinacea spp. I litteraturen går studien for å være metodisk god, men forfatterne har fått kritikk for å ha benyttet Echinacea angustifolia. Denne arten er den av de tre omtalte Echinacea-artene, som ikke anerkjennes for medisinsk bruk avekspertpanelet «The German Commision E» fordi det finnes for lite dokumentasjon. I tillegg har forfatterne av studien fått kritikk for å ha brukt i underkant av en tredjedel av dosen som er normaldosen angitt i en WHO monografi for «Radix echinacea» (WHO, 1999). Dessuten, i det ekstraktet som skulle inneholde mest kaffesyrederivater, fant de ikke hoved-kaffesyrederivatet echinacosid, noe som kan så tvil om ekstraksjonsbetingelsene eller utgangsdrogen.
Shah og medarbeidere (2007) har i en meta-analyse undersøkt 14 studier som ble vurdert å være av akseptabel kvalitet (av totalt 73 kliniske studier) for å vurdere om Echinacea kan ha effekt på hyppigheten og varigheten av vanlig forkjølelse. De fant at Echinacea både reduserer antall tilfeller og varigheten av vanlig forkjølelse. Disse forfatterne mener også at Echinacea har en profylaktisk effekt ved vanlig forkjølelse. De mener å se at Echinacea virker bedre på forkjølelser grunnet andre viruser enn rhinovirus.
I The Cochrane Library er det i 2008 publisert en fornyet oversikt der det vurderes om Echinacea virker profylaktisk eller terapeutisk ved vanlig forkjølelse (Linde et al., 2008). Tjueto akseptable sammenlikningsstudier blir vurdert, og forfatterne kommer til at profylaktisk behandling sannsynligvis ikke er effektiv, men de sier at overjordisk del (herba) av Echinacea purpurea kan se ut til å ha en effekt ved behandling på et tidlig stadium av vanlig forkjølelse hos voksne.
Vanligvis setter forfattere av oversiktsartikler og meta-analyser høye krav til kliniske studier for å inkludere dem i sin vurdering. Når det gjelder kliniske studier på Echinacea, er det dessverre vanlig at forfatterne behandler Echinacea-preparater produsert fra forskjellig art, forskjellig plantedel og med forskjellige innholdsstoffer, som like.
KONKLUSJON
Det er klare variasjoner i innhold av polysakkarider, glykoproteiner, kaffesyrederivater og alkamider, stoffer assosiert med biologisk aktivitet, i de tre Echinacea-artene E. purpurea, E. pallida og E. angustifolia. Eksempler på tynnsjiktskromatografi av ekstrakter fra disse artene viser i tillegg store variasjoner i innhold av andre substanser. In vitro-studier på flere forskjellige enkeltstoffer eller grupper av stoffer isolert fra de tre artene har vist effekt på en eller flere immunologiske parametre. Monocytter og makrofager ser ut til å være de celletypene som responderer mest. Effekt sees av både vannekstrakter og alkoholekstrakter. Det er ikke identifisert én enkelt substans eller en enkelt gruppe innholdsstoffer fra Echinacea-arter som er assosiert med en medisinsk effekt. Ulikheter i innholdsstoffer og biologisk aktivitet må få konsekvenser for vurdering av kliniske studier. Skal man trekke bastante (positive eller negative) konklusjoner av kliniske studier med Echinacea-preparater, må det foreligge data fra flere sammenliknbare studier med én bestemt art. Det må benyttes ett godt definert plantepreparat der ekstraksjonsbetingelser og innhold av alle de antatt virksomme substanser er vel beskrevet. Dessuten må type pasientgruppe og type infeksjon som skal detekteres være nøye definert. Egentlig burde disse studiene sammenliknes med identiske studier på isolerte enkeltsubstanser fra samme droge. I tillegg må alle regler for metodisk godt oppsett av kliniske studier følges, med nok pasienter til å få statistisk signifikante resultater, og et nøye regime for når, hvordan og hvor myepreparat som skal tas. I de kliniske studier som er gjort på Echinacea-preparater mangler det mye på at dette er tilfelle.
Oppgitte interessekonflikter: Ingen
Referanser
Alban S, Classen B, Brunner G et al. Differentiation between the complement modulating effects of an arabinogalactan-protein from Echinacea purpurea and heparin. Planta Med 2002; 68: 1118-1124.
Bauer R. Echinacea: biological effects and active principles. I: Lawson, LD., Bauer R. (red.) Phytomedicines in Europe. Chemistry and biological activity. American Chemical Society, Washington DC. 1998: 140-157.
Bauer R. Clinical investigations of Echinacea phytopharmaceuticals. I: Wagner H. (red.) Immunomodulatory agents from plants. Birkhäuser Verlag, Basel 1999: 41-88.
Binns SE, Hudson J, Merali S et al. Antiviral activity of characterized extracts from Echinacea spp. (Heliantheae: Asteraceae) against Herpes Simplex Virus (HSV-I). Planta Med 2002; 68: 780-783.
Chicca A, Pellati F, Adinolfi B et al. Cytotoxic activity of polyacetylenes and polyenes isolated from roots of Echinacea pallida. Brit J Pharmacol 2008; 153: 879-885.
Classen B, Mau S-L, Bacic A. The arabinogalactan-protein from pressed juice of Echinacea purpurea belong to the «hybrid» class of hydroxyproline-rich glycoproteins. Planta Med 2005; 71: 59-66.
Classen B, Thude S, Blaschek W et al. Immunomodulatory effects of arabinogalactan-proteins from Baptisia and Echinacea. Phytomedicine 2006; 13: 688-694.
Dalby-Brown L, Barsett H, Landbo A-KR et al. Synergistic antioxidative effects of alkamides, caffeic acid derivatives, and polysaccharide fractions from Echinacea purpurea on in vitro oxidation of human low-density lipoproteins. J Agric Food Chem 2005; 53: 9413-9423.
Dong G-C, Chuang P-H, Chang K-C et al. Blocking effect of an immuno-suppressive agent, Cynarin, on CD28 of T-cell reseptor. Pharmaceut Res 2009; 26: 375-381.
Emmendörffer A, Wagner H, Lohmann-Matthes ML. Clinical investigations of Echinacea phytopharmaceuticals. I Wagner, H. (red.) Immunomodulatory agents from plants. Birkhäuser Verlag, Basel 1999: 89-104.
European Pharmacopoeia: Determination of essential oils in herbal drugs. Council of Europe, Strasbourg, 6th edition; vol 1: 251-252
Gertsch J, Schoop R, Kuenzle U et al. Echinacea alkylamides modulate TNF-α gene expression via cannabinoid receptor CB2 and multiple signal transduction pathways. FEBS Lett 2004; 577: 563-9.
Goel V, Chang C, Slama JV et al. Echinacea stimulates macrophage function in the lung and spleen of normal rats. J Nutr Biochem 2002; 13: 487-492.
Guiotto P, Woelkart K, Grabnar I et al. Pharmacokinetics and immunomodulatory effects of phytotherapeutic lozenges (bonbons) with Echinacea purpurea extract. Phytomedicine 2008; 15: 547-554.
Hall C. Echinacea as a functional food ingredient. Adv Food Nutr Res 2003; 47:113-173.
Linde L, Barrett B, Bauer R et al. Echinacea for preventing and treating the common cold. Cochrane Database Syst Rev 2008; 4.
Manzanares W, Hardy G. The role of prebiotics and synbiotics in critically ill patients. Curr Opin Clin Nutr Metab Care 2008; 11: 782-789
Matthias A, Banbury L, Bone KM et al. Echinacea alkylamides modulate induced immune responses in T-cells. Fitoterapia 2008; 79: 53-58.
Michaelsen TE, Gilje A, Samuelsen AB et al. Interaction between human complement and a pectin type polysaccharide fraction, PMII, from leaves of Plantago major L. Scand. J. Immunol. 2000; 52: 483-490.
Morazzoni P, Cristoni A, DiPierro F et al. In vitro and in vivo immune stimulation effects of a new standardized Echinacea angustifolia root extract (PolinaceaTM). Fitoterapia 2005; 76: 401-411
Pillai S, Pillai C, Mitscher LA et al. Use of quantitative flow cytometry to measure ex vivo immunostimulant activity of Echinacea: the case for polysaccharides. J Altern Compl Med 2007; 13: 625-634.
Raknes G, Småbrekke L. Echinacea spp. (solhatt) og øvre luftveisinfeksjon. Tidsskr Nor Lægeforen 2006; 126: 2526-2527.
Reinke RA, Lee DJ, McDougall BR et al. L-chicoric acid inhibits human immunodeficiency virus type 1 integration in vivo and is a noncompetitive but reversible inhibitor of HIV-1 integrase in vitro. Virology 2004; 326: 203-219.
Shah SA, Sander S, White CM et al. Evaluation of echinacea for the prevention and treatment of the common cold: a meta-analysis. Lancet Infect Dis 2007; 7: 473-480.
Speroni E, Govoni P, Guizzardi S et al. Anti.inflammatory and cicatrizing activity of Echinacea pallida Nutt. Root extract. J Ethnopharmacol 2002; 79: 265-272.
Sullivan AM, Laba JG, Moore JA et al. Echinacea-induced macrophage activation. Immunopharmacol Immunotoxicol 2008; 30: 553-574.
Thude S, Classen B. High molecular weight constituents from root of Echinacea pallida: An arabinogalactan-protein and an arabinan. Phytochemistry 2005; 66: 1026-1032.
Thude S, Classen B, Blaschek W et al. Binding studies of an arabinogalactan-protein from Echinacea purpurea to leucocytes. Phytomedicine 2006; 13: 425-427.
Turner RB, Bauer R, Woelkart K et al. An evaluation of Echinacea angustifolia in experimental rhinovirus infections. N Engl J Med 2005; 353: 341-348.
Wagner H, Bladt S. Plant drug analysis. 2. utgave, Springer Verlag, Berlin. 1996.
WHO, Radix Echinacea, in WHO monographs on selected medicinal plants, World Health Organisation, Geneve 1999: 125-135.
Woelkart K, Koidl C, Grisold A et al. Bioavailability and pharmacokinetics of alkamides from the roots of Echinacea angustifolia in humans. J Clin Pharmacol 2005; 45: 683-689.
Woelkart K, Salo-Ahen OMH, Bauer R. CB receptor ligands from plants. Curr Top Med Chem 2008; 8: 173-186.
Wu CH, Murthy HN, Hahn EJ et al. Efficient extraction of caffeic acid derivatives from adventitious roots of Echinacea purpurea. Czech J Food Sci.2008; 26: 254-258.
Zhai Z, Liu Y, Wu L et al. Enhancement of innate and adaptive functions by multiple Echinacea species. J Med Food 2007; 10: 423-434.
Manuskriptet ble mottatt 30. april 2009 og godkjent 20. juni 2009.
Fagredaktør Berit Smestad Paulsen.
Norsk Farmaceutisk Tidsskrift 2009; 7-8: 18–22.
