Varianter i genet for tiopurin S-metyltransferase (TPMT) avgjør dosering av tiopurinlegemidler
Varianter i genet kan i verste fall bety livstruende bivirkninger for en pasient som får azatioprin i normaldose. Hvordan kan det bli så dramatisk? Da må det straks tilføyes at dette gjelder kun en liten andel av pasientene, cirka 1 av 400 i vår del av verden. Men for en større gruppe pasienter, nærmere 10 prosent, kan det også ha betydning for optimal dosering. Forklaringen kommer her.
Tiopurinlegemidler (azatioprin, merkaptopurin og tioguanin) har vært i bruk siden 50-tallet og er fortsatt i utstrakt bruk ved en rekke indikasjoner. Merkaptopurin inngår som et viktig ledd i behandlingen av akutt lymfatisk leukemi, mens azatioprin brukes ved inflammatorisk tarmsykdom, autoimmun hepatitt, leddgikt og en rekke andre autoimmune sykdommer. Det er for øvrig mest historiske årsaker til forskjellig bruksområde for disse to preparatene; azatioprin omdannes umiddelbart til merkaptopurin slik at disse har samme metabolismeveier og virkninger, men med ulik dosering på grunn av forskjellene i molekylvekt.
Metabolisme av tiopuriner
Tiopurinene har en spesiell metabolisme som i stor grad følger mønsteret for endogene puriner. Det vil si at de gjennom flere enzymatiske trinn omdannes til de aktive substansene, tioguanin-nukleotider (6-TGN), se figur 1. Det er via disse metabolittene tiopurinene utøver sin virkning. Den viktigste mekanismen går via innbygging i DNA og RNA og påfølgende hemming av celledeling. I senere tid har man funnet at tiopurinene også kan virke ved å hemme cellesignalering. Tiopurinene omdannes også til tiourinsyre, som er uten virkning, og som skilles ut i urinen. En spesiell egenskap med tiopurinene er at de har en tredje metabolismevei, nemlig via enzymet tiopurin S-metyltransferase (TPMT). Dette kan gjelde på flere trinn, men hovedsaken er at en stor andel av en tiopurindose vil følge denne veien og bli omdannet til metyl-merkaptopurin-forbindelser (meMP; figur 1). Disse metylerte forbindelsene regnes som inaktive, men kan bidra til levertoksisitet hvis konsentrasjonene blir ekstra høye.
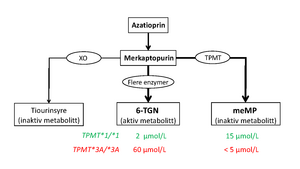
Noe forenklet vises her de tre hovedveiene for metabolisme av azatioprin og merkaptopurin. Eksempler på målte nivåer av henholdsvis 6-TGN og meMP er vist i grønt for en pasient med normal TPMT-genotype (*1/*1), mens resultatene i rødt er målt hos pasient med inaktiverende varianter i begge alleler (*3A/*3A). For mer detaljert forklaring, se teksten.
6-TGN = tioguaninnukleotider, det vil si summen av mono-, di- og trifosfat av tioguanin(deoksy)ribosid; meMP = metyl-merkaptopurin. XO = xantinoksydase
Aktiviteten til enzymet TPMT varierer i stor grad mellom individer, og en stor del av denne variasjonen skyldes TPMT-genvarianter. Akkurat som for CYP-enzymene bruker vi «*1» som betegnelse på den normale TPMT-gensekvensen, det vil si den som gir normalt protein og normal enzymaktivitet. Hvis begge alleler er *1, vil TPMT-aktiviteten altså inaktivere en stor del av tiopurindosen. Dette fører til at konsentrasjonen av meMP (inaktiv) i blodet kan være cirka 10 ganger så høy som konsentrasjonen av 6-TGN (aktiv), slik det er vist i figur 1 med 6-TGN på 2 µmol/L og meMP på 15 µmol/L. Dette forholdet kan variere ganske mye mellom pasienter og også for en pasient over tid. De hyppigst forekommende TPMT-variantene som påvirker enzymaktiviteten, har fått betegnelsene *3A, *3C, *16 og *2. En slik variant fører til at aktiviteten av TPMT-enzymet blir svært lav eller fraværende. Det betyr at de som er heterozygote for normal og avvikende variant, for eksempel *1/*3A, vil få sin TPMT-aktivitet halvert. Og siden metyleringsveien er så kvantitativt viktig, kan dette bety at en normal dose gir betydelig forhøyet 6-TGN og dermed fare for bivirkninger i form av benmargssuppresjon og annen toksisitet. Og som nevnt innledningsvis: for de som har varianter i begge alleler, vil en normal dose av azatioprin eller merkaptopurin etter kort tid gi skyhøye konsentrasjoner av 6-TGN, slik det andre eksemplet i figur 1 viser. Dette vil gi nærmest garantert sterk hemming av benmargen hvis doseringen fortsetter.
Nå er det ikke slik at det alltid vil være perfekt samsvar mellom TPMT-genotype og målte konsentrasjoner av tiopurinmetabolittene. En forklaring kan være at det finnes flere genvarianter, som hver for seg er sjeldne, men som til sammen utgjør en andel på noen få prosent. Dette er demonstrert i et stort materiale av skandinaviske pasienter, nylig publisert i avhandlingen som er sitert til slutt her. Dersom man etter hvert går over til sekvensering av hele det aktuelle genet, vil også disse sjeldnere variantene bli fanget opp.
Klinisk bruk av TPMT-genotyping
Hvordan kan denne kunnskapen utnyttes i praksis, til pasientenes beste? Doseringen ved akutt lymfatisk leukemi er spesiell fordi man enkelt sagt ønsker å gi så høy dosering av merkaptopurin som pasienten kan tåle, for å sikre effekt på leukemien. Protokoller for slik behandling spesifiserer at man sjekker TPMT-genotype før oppstart for å identifisere de pasientene hvor lavere dosering bør vurderes. Når det gjelder immunsykdommene, har det særlig for inflammatorisk tarmsykdom vært gjort mye forskning for å definere terapeutisk område for 6-TGN. Dette har også i en viss grad blitt ekstrapolert til andre indikasjoner. Etter at de biologiske legemidlene gjorde sitt inntog, fant man etter hvert ut at det antakelig var fordeler med å kombinere biologiske legemidler med azatioprin, men nå med lavere konsentrasjonsområde. Derfor er analyse av 6-TGN og meMP i blod et viktig verktøy for å individualisere behandlingen med azatioprin.
Spørsmålet er så om alle som skal få tiopuriner, bør få utført TPMT-genotyping først? Ifølge internasjonale retningslinjer er dette en av de farmakogenetiske undersøkelser der man kan gi tydelige og veldefinerte anbefalinger om startdose basert på genotype. Det er imidlertid også stor variasjon i hvilke 6-TGN- og meMP-konsentrasjoner som oppnås innen gruppen med normal TPMT. Derfor er det anbefalt å gjøre minst et par målinger av disse metabolittene etter start av behandlingen. Siden det kan ta noen uker før 6-TGN-konsentrasjonen bygger seg opp, kan man også velge å starte behandling uten forutgående TPMT-test, siden man kan rekke å justere doseringen før bivirkningene kommer. For de få pasientene som viser seg å ha TPMT-genvarianter i begge alleler, vil det imidlertid være helt avgjørende at dette er kjent før oppstart. De skal ha meget lave doser fra start hvis man ikke heller velger en annen behandling. Hvis man ellers velger å se an 6-TGN uten å gjøre TPMT-genotyping, kan man eventuelt gjøre genotyping etter start av behandling kun hos de pasienter der man ser høyere 6-TGN enn forventet. Fordelen med å kjenne genotypen er jo at man da vet at dette er en faktor som ikke forandres gjennom livet, og som dermed har en varig påvirkning av dosebehovet. Dette i motsetning til andre forbigående påvirkninger som eventuelle legemiddelinteraksjoner eller andre effekter. Det skal også nevnes at en alternativ tilnærming kan være å gjøre fenotyping av TPMT-aktivitet.
Når først metabolismeveier, betydningen av enzymet TPMT og tilhørende genotyper ble kjent for tiopurinene, etter empirisk bruk gjennom tiår, er dette blitt et eksempel på legemiddel-gen-par hvor relasjonen er relativt oversiktlig. Her kan man gi tydelige og etter hvert godt underbygde anbefalinger om dosering og hvordan denne best kan tilpasses for den enkelte pasient. Dette avspeiles også i økende grad i klinisk praksis for flere av indikasjonene for behandling med tiopuriner.
Videre lesning:
Relling MV, Schwab M, Whirl-Carrillo M et al. Clinical Pharmacogenetics Implementation Consortium Guideline for Thiopurine Dosing Based on TPMT and NUDT15 Genotypes: 2018 Update. Clin Pharmacol Ther 2019; 105: 1095–105.
Kahlin AZ. Pharmacogenetic studies of thiopurine methyltransferase genotype-phenotype concordance and effect of methotrexate on thiopurine metabolism. Linköping University Medical Dissertation No. 1723: Linköping University; 2020.
(Publisert i NFT nr. 9/2020 side 42–43)
